题目内容
【题目】下列指定反应的离子方程式正确的是( )
A.醋酸溶解水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
B.向氨水中通入过量SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
C.用石墨作电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓
【答案】D
【解析】
A.碳酸钙和醋酸都需要保留化学式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO,故A错误;
B.向氨水中通入过量SO2,反应生成亚硫酸氢铵,正确的离子方程式为:NH3·H2O+SO2═NH4++HSO3,故B错误;
C.因电解时在阴极附近产生了大量OH-,OH-能与Mg2+反应:Mg2++2OH-=Mg(OH)2↓,离子反应:Mg2++2Cl-+2H2O![]() Cl2↑+H2↑+Mg(OH)2↓,故C错误;
Cl2↑+H2↑+Mg(OH)2↓,故C错误;
D.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合恰好全部转化为沉淀,离子反应为:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓,故D正确;
答案选D。

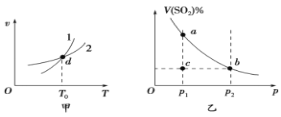
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是__。
SO2压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2molSO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
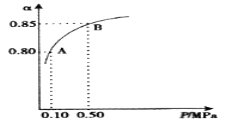
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。平衡状态由A变到B时,平衡常数K(A)__K(B)(填“>”、“<”或“=”),B点的化学平衡常数是__。
(4)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,t1时刻达到平衡,测得容器中含SO30.18mol。
①tl时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是__。
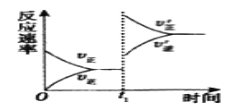
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20molSO2和0.10molO2,则平衡__移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,_mol<n(SO3)<_mol。