题目内容
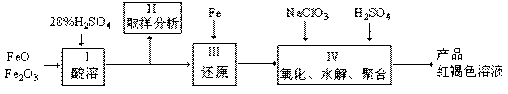
聚合硫酸铁(PPS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有_____________。
A.容量瓶 b.烧杯 c.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是_______________________________。
A.控制溶液中Fe2+与Fe3+含量比
b.确定下一步还原所需铁的量
c.确定氧化Fe2+所需NaClO3的量
d.确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4====3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4====3Fe2(SO4)3+2NO↑+4H2O
已知1 mol HNO3价格0.16元、1 mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊。利是_____________________________,弊是__________________________________。
聚合硫酸铁溶液中SO![]() 与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO
与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO![]() 与Fe3+物质的量之比。
与Fe3+物质的量之比。
(4)测定时所需的试剂有__________。
A.NaOH b.FeSO4
C.BaCl2 d.NaClO3
(5)需要测定__________和__________的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作__________(按操作先后顺序列出)。
A.萃取、分液 b.过滤、洗涤 c.蒸发、结晶 d.冷却、称量 e.烘干或灼烧
(1)b (2)bc
(3)原料成本较低 产生气体对大气有污染
(4)ac (5)Fe2O3 BaSO4 (6)bed
解析:本题主要考查了化学实验基本操作,Fe2+和Fe3+性质以及化工生产的综合经济效益问题。
(2)取样分析溶液中Fe2+、Fe3+的含量,主要是为下面的步骤需加多少试剂提供依据。
(3)主要从经济效益和环境保护的角度分析。
(4)要测出聚合硫酸铁中SO![]() 与Fe3+的物质的量之比,必须分别测出一定量的试样中SO
与Fe3+的物质的量之比,必须分别测出一定量的试样中SO![]() 和Fe3+的物质的量。
和Fe3+的物质的量。