题目内容
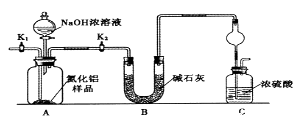
【题目】某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。
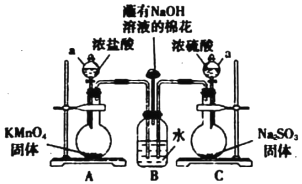
(1)图中仪器a的名称为_______。
(2)装置A中的反应为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,反应中的氧化剂是_____,生成71gCl2转移的电子是______mol。
(3)装置B中蘸有NaOH溶液的棉花的作用是______________。
(4)打开A、C装置a的活塞,一段时间后关闭活塞。待反应完全后.小组同学又继续做如下实验。
①甲同学取适量B中溶液于试管中,向其中滴加少量AgNO3溶液,有白色沉淀生成。甲同学由此认为SO2和Cl2,发生了反应,理由是该反应中生成了___________(填离子符号)。
②乙同学认为甲同学的结论不合理,认为A中生成的Cl2中混有杂质,应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法即可得到正确结论,乙同学认为Cl2中混有的杂质是_______,洗气瓶中盛有试剂的名称是____________。
③丙同学认为甲、乙两位同学的结论均不合理。丙同学取适量B中溶液于试管中,向其中滴加少量溶液X,有白色沉淀生成,得出结论即SO2与Cl2同时通入水中,可以发生反应。溶液X__________(填选项序号)。
a.BaCl2溶液 b.Ba(OH)2溶液 c.Ba(NO3)2溶液
【答案】 分液漏斗 KMnO4 2 尾气处理,防止污染空气 Cl- HCl 饱和食盐水 a
【解析】(1)图中仪器a为分液漏斗,用来盛放浓盐酸,控制滴加液体的速率;(2)元素化合价升高的失电子做还原剂,元素化合价降低的做氧化剂,装置A中的反应为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,Mn元素化合价降低,反应中的氧化剂是KMnO4,氯元素化合价从-1价升高到0价,71g Cl2的物质的量是1mol,电子转移2mol;(3)氯气有毒污染空气,不能排放需要用氢氧化钠吸收剩余氯气,因此装置B中蘸有NaOH溶液的棉花的作用是吸收氯气尾气处理,防止污染空气;(4)①二氧化硫和氯气发生氧化还原反应生成了氯化氢,氯离子遇到银离子生成白色沉淀,向其中滴加少量AgNO3溶液,有白色沉淀生成,甲同学由此认为SO2和Cl2发生了反应的依据是氯气被还原为氯离子;②制备氯气中含有氯化氢和水蒸气,氯化氢进入B中溶于水也会生成氯离子,乙同学认为Cl2中混有的杂质是HCl,需要在AB间增加一个洗气瓶,用饱和食盐水除去;③二氧化硫被氯气氧化为硫酸,结合硫酸根离子检验证明二氧化硫和氯气发生了反应,丙同学取适量B中溶液于试管中,向其中滴加少量溶液X含钡离子,且不能和二氧化硫发生反应,则a、氯化钡溶液可以检验硫酸根离子存在,证明二氧化硫和氯气发生了反应,a正确;b、氢氧化钡和二氧化硫反应生成亚硫酸钡沉淀,不能说明二氧化硫和氯气发生反应,b错误;c、硝酸钡溶液中存在硝酸根离子,二氧化硫在溶液中被氧化为硫酸,也会生成硫酸钡沉淀,不能说明二氧化硫和氯气反应,c错误;答案选a。

【题目】将一定量Na2O2和NaHCO3混合后,在密闭容器中加热充分反应,排除气体,冷却后有固体物质剩余,下列选项不正确的是( )
Na2O2(mol) | NaHCO3(mol) | 固体成分 | |
A | 1 | 2 | Na2CO3 |
B | 1.5 | 2 | Na2CO3、NaOH、Na2O2 |
C | 1 | 1 | Na2CO3、NaOH |
D | 2 | 1 | Na2CO3、NaOH、Na2O2 |
A. A B. B C. C D. D