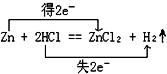
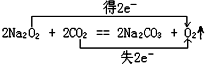
题目内容
用下列方法制取氧气:
①KMnO4受热分解②KClO3受热分解(用MnO2作催化剂)
③2H2O2
2H2O+O2↑④2Na2O2+2H2O═4NaOH+O2↑
若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是( )
①KMnO4受热分解②KClO3受热分解(用MnO2作催化剂)
③2H2O2
| ||
若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是( )
| A.3:2:1:4 | B.1:1:1:1 | C.1:2:1:2 | D.2:2:1:1 |
加热高锰酸钾的方程式为2KMnO4
K2MnO4+MnO2+O2↑,转移电子是4mol,氯酸钾分解反应的方程式为2KClO3
2KCl+3O2↑,转移电子是12mol,2H2O2
2H2O+O2↑,转移电子是2mol,2Na2O2+2H2O═4NaOH+O2↑转移电子是2mol,当获得氧气的质量均是32g,即1mol时,转移电子数分别是4mol、4mol、2mol、2mol,所以所转移的电子数目之比是2:2:1:1.
故选D.
| ||
| ||
| ||
故选D.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目