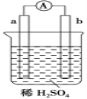
题目内容
【题目】1.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,氢氧燃料电池以KOH溶液为电解质,其总反应的化学方程式为2H2+O2=2H2O。
(1)负极上的电极反应为______。
(2)消耗标准状况下的5.6LO2时,有____mol电子发生转移。
(3)工作过程中时,溶液的c(OH-)____(填“增大”、“减小”或“不变”)。
2.证明卤族元素的非金属性强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检查)。
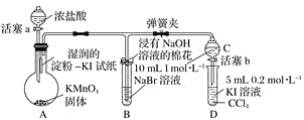
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是________。
(2)B中溶液发生反应的离子方程式是________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是______。
(4)过程Ⅲ实验的目的是________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐___,得电子能力逐渐____。
【答案】H2-2e-+2OH-=2H2O; 1.0 减小 淀粉碘化钾试纸变蓝 Cl2+2Br-=Br2+2Cl- 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静止后四氯化碳层溶液变为紫红色 确认C的黄色溶液中无氯气,排除氯气对溴置换碘实验的干扰 增大 减弱
【解析】
1.(1)原电池中失电子的电极是负极,负极失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(2)计算出氧气的物质的量即可求出转移电子数;
(3)根据电池总反应式确定溶液的氢氧根离子浓度的变化
2.(1)圆底烧瓶上部的湿润的淀粉碘化钾试纸,是为了验证氯气的氧化性强于碘;
(2)B中是NaBr溶液,Cl2氧化Br-生成Br2 ;
(3)为验证溴的氧化性强于碘,生成的碘用四氯化碳萃取后观察现象;
(4过程Ⅲ实验的目的是确认C的黄色溶液中无氯气,排除氯气对溴置换碘实验的干扰 ;
(5)同一主族元素,从上到下,电子层数增多,原子半径增大,原子核对外层电子引力减弱,得电子能力减弱。
1.(1)氢氧燃料电池中,氢气在负极失电子,电极反应式为H2-2e-+2OH-=2H2O;
答案:H2-2e-+2OH-=2H2O;
(2)5.6L 氧气的物质的量为:![]() ═0.25mol,根据电极反应:O2+4e-+2H2O═4OH-,消耗5.6L(标准状况下)O2时,转移电子数为:0.25mol×4═1.0mol;
═0.25mol,根据电极反应:O2+4e-+2H2O═4OH-,消耗5.6L(标准状况下)O2时,转移电子数为:0.25mol×4═1.0mol;
答案:1.0
(3)总反应2H2+O2=2H2O,电解质溶液中水的量越来越多,c(OH-)减小;
答案:减小
2.(1)圆底烧瓶上部的湿润的淀粉碘化钾试纸,是为了验证氯气的氧化性强于碘,Cl2+2I-=2Cl-+I2 ,实验现象是湿润的淀粉KI试纸变蓝;
答案:淀粉碘化钾试纸变蓝
(2)B中是NaBr溶液,Cl2氧化Br-生成Br2 ,反应的离子方程式是Cl2+2Br-=2Cl-+Br2;
答案:Cl2+2Br-=Br2+2Cl-
(3)为验证溴的氧化性强于碘,打开活塞b,将少量C中溶液滴入D中,关闭活塞b,生成的碘,取下D振荡后静置,碘在四氯化碳中呈紫红色,四氯化碳的密度比水大在下层,观察到的现象是下层CCl4从无色变为紫红色;
答案:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静止后四氯化碳层溶液变为紫红色
(4)过程Ⅲ实验的目的是确认C的黄色溶液中无氯气,排除氯气对溴置换碘实验的干扰 ;
答案:确认C的黄色溶液中无氯气,排除氯气对溴置换碘实验的干扰
(5)同一主族元素,从上到下,电子层数增多,原子半径增大,原子核对外层电子引力减弱,得电子能力减弱。
答案:增大 减弱