题目内容
【题目】Ⅰ.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式__________。
(2)下列三种情况下,离子方程式与(1)相同的是____(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液中显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO![]() 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
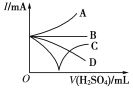
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用右图中的___曲线表示(填序号)。
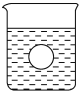
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将____________。
Ⅱ.某地甲、乙两厂排放污水,污水中含有下列8种离子中的4种:Ag+、Ba2+、Fe3+ 、Na+、Cl-、SO42-、NO3-、OH-(两厂所排污水不含相同离子)。两厂单独排放都会造成严重的水污染(其中甲厂的污水是碱性的),如将两厂的污水按一定比例混合,沉淀后的污水变成无色澄清的几乎只含硝酸钠的溶液而排放,污染程度会大大降低。关于两厂所排污水中所含的4种离子,你认为应该是:甲厂:________;乙厂________。
【答案】Ba2++2OH-+SO42-+2H+===BaSO4↓+2H2O A C 沉到烧杯底部 OH- Cl- SO42- Na+ Fe3+ Ba2+ Ag+ NO3—
【解析】
Ⅰ.(1)反应生成硫酸钡和水,硫酸钡和水在离子反应中均保留化学式;
(2)恰好完全反应时,溶液为中性;
(3)加入稀硫酸直至过量,恰好反应时导电性为0,过量后离子浓度增大,导电性增强;
(4)向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应,生成硫酸钡和水,溶液的密度小于Ba(OH)2溶液的密度.
Ⅱ.将两厂的污水按一定比例混合,沉淀后的污水变成无色澄清的几乎只含硝酸钠的溶液而排放,污染程度会大大降低,说明甲乙两厂的废水能反应生成沉淀,从离子能否大量共存的角度分析,甲厂呈碱性,可假设乙厂含有Ag+,则一定不含SO42-、OH-、Cl-,则SO42-、OH-、Cl-应存在与甲厂,因Ba2+与SO42-、Fe3+与OH-不能共存,则Fe3+、Ba2+存在于乙厂,根据溶液呈电中性可知,乙厂一定存在NO3-;所以乙厂含有的离子有:Ag+、Ba2+、Fe3+、NO3-,甲厂含有的离子为:Na+、Cl-、SO42-、OH-。
Ⅰ.(1)反应生成硫酸钡和水,离子反应为Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O;
(2)离子方程式(1)反应后溶液为中性,
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性,离子反应为Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故A选;
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀,离子反应为Ba2++OH-+SO42-+H+═BaSO4↓+H2O,故B不选;
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,离子反应为Ba2++OH-+SO42-+H+═BaSO4↓+H2O,故C不选;
故选A;
(3)加入稀硫酸直至过量,恰好反应时导电性为0,过量后离子浓度增大,导电性增强,图中只有C符合;
(4)向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应,生成硫酸钡和水,溶液的密度小于Ba(OH)2溶液的密度,塑料小球将沉到烧杯底部。
Ⅱ.将两厂的污水按一定比例混合,沉淀后的污水变成无色澄清的几乎只含硝酸钠的溶液而排放,污染程度会大大降低,说明甲乙两厂的废水能反应生成沉淀,从离子能否大量共存的角度分析,甲厂呈碱性,可假设乙厂含有Ag+,则一定不含SO42-、OH-、Cl-,则SO42-、OH-、Cl-应存在与甲厂,因Ba2+与SO42-、Fe3+与OH-不能共存,则Fe3+、Ba2+存在于乙厂,根据溶液呈电中性可知,乙厂一定存在NO3-;所以乙厂含有的离子有:Ag+、Ba2+、Fe3+、NO3-,甲厂含有的离子为:Na+、Cl-、SO42-、OH-。



