题目内容
3.有浓度均为0.1mol•L-1的盐酸、硫酸和醋酸三种溶液,试分析:(1)若溶液的C(H+)分别为a、b、c,则它们的大小关系是b>a>c(用“>”“<”“=”表示),
(2)分别用三种酸中和等物质的量的氢氧化钠溶液,所需溶液的体积分别是a、b、c,则它们的大小关系是a=c=2b(用“>”“<”“=”表示).
(3)等体积的三种酸分别与足量的锌粒反应,在相同条件下若产生气体的体积分别为a、b、c,则它们的关系是a=c=$\frac{1}{2}$b.
(4)可逆反应2Cl2(g)+2H2O(g)?4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率减小;
②保持容器体积不变,加入He,则HCl的物质的量不变;
③保持容器压强不变,加入He,则O2的体积分数增大.
分析 (1)硫酸和盐酸是强酸,醋酸是弱酸,则c(H+)=c(HCl),c(H+)=2c(H2SO4),c(H+)<c(CH3COOH);
(2)酸碱中和时,氢元素的物质的量和氢氧根离子的物质的量相等;
(3)根据氢原子守恒计算生成氢气体积的大小关系;
(4)①降低温度,平衡逆移,Cl2的转化率 减小;
②保持容器体积不变,加入He,对反应无影响,所以HCl的物质的量不变.
③保持容器压强不变,加入He,体积变大,反应物所占分压减小,平衡正移,则O2的体积分数增大.
解答 解:(1)硫酸和盐酸是强酸,醋酸是弱酸,则c(H+)=c(HCl)=0.1mol/L,c(H+)=2c(H2SO4)=0.2mol/L,c(H+)<c(CH3COOH)=0.1mol/L,所以它们的大小关系是b>a>c,故答案为:b>a>c;
(2)三种酸的浓度相等,盐酸和醋酸都是一元酸,硫酸是二元酸,硫酸溶液中氢离子浓度是盐酸溶液中的2倍,则完全中和物质的量均相同的三份NaOH溶液时,盐酸和醋酸需要的体积相等,需要硫酸的体积是盐酸的一半,所以需三种酸的体积大小关系是a=c=2b,故答案为:a=c=2b;
(3)等体积等浓度的三种酸中,氢元素的物质的量2n(HCl)=2n(CH3COOH)=n((H2SO4),根据氢原子守恒知,生成氢气的体积大小顺序是a=c=$\frac{1}{2}$b,
故答案为:a=c=$\frac{1}{2}$b;
(4)①该反应的正方向为吸热反应,所以降低温度,平衡逆移,Cl2的转化率 减小;故答案为:减小;
②保持容器体积不变,加入He,容器体积不变,各物质的浓度不变,所以对反应无影响,所以HCl的物质的量不变,故答案为:不变;
③保持容器压强不变,加入He,体积变大,反应物所占分压减小,平衡正移,则O2的体积分数增大,故答案为:增大.
点评 本题考查电解质的电离、温度、压强对化学平衡的影响,注意平衡移动对总物质的量、密度、平均分子量的影响,题目难度不大.

| A. | H2SO3?2H++SO32- | B. | H2CO3+H2O?H3O++HCO3- | ||
| C. | NaHS═Na++H++S2- | D. | HF═H++F- |
| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3mol | D. | 0.15 mol |
| A. | 硫酸铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | NaHCO3溶液中加入氢氧化钠溶液:OH-+HCO3-═CO2↑+H2O |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成.根据上述实验填空:
(1)写出B、D的化学式:BKCl,DCuSO4.
(2)C可用作净水剂,用离子方程式表示其净水原理Al3++3H2O═Al(OH)3+3H+.
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1mol•L-1稀盐酸.如图图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是C.

(4)在mmL bmol•L-1 C溶液中,加入等体积a mol•L-1的E溶液.当a≤3b时,生成沉淀的物质的量是$\frac{am}{3000}$mol;当3b<a<4b件时,生成沉淀的物质的量是(4bm-am)×10-3mol.
| A. | 1mol稀硫酸与足量NaOH溶液反应 | |
| B. | 稀盐酸与稀Ba(OH)2溶液反应生成1mol水 | |
| C. | 稀盐酸与氨水反应生成1mol水 | |
| D. | 稀NaOH与95%浓硫酸反应生成1mol水 |
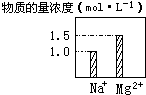 在0.2L NaCl、MgCl2的混合溶液中,部分离子浓度大小如图所示,
在0.2L NaCl、MgCl2的混合溶液中,部分离子浓度大小如图所示,