题目内容
【题目】用以下三种途径来制取等质量的硝酸铜.
①铜与稀硝酸反应;②铜与浓硝酸反应;③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应.
以下叙述不正确的是( )
A.三种途径所消耗的铜的质量相等
B.所消耗的硝酸的物质的量是①>②>③
C.途径③的制备方法是最符合“绿色化学”理念的
D.途径①中被氧化的铜与被还原的硝酸的物质的量比是3:2
【答案】B
【解析】解:方案中节约原料,则反应需步骤简单,消耗原料较少,为防止污染环境,应尽量少产生或不产生污染性气体.
①铜与稀硝酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,制备1molCu(NO3)2 , 需要 ![]() molHNO3 , 生成
molHNO3 , 生成 ![]() mol有毒的NO气体;
mol有毒的NO气体;
②铜与浓硝酸反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,制备1molCu(NO3)2 , 需要2molHNO3 , 生成的2molNO2气体有毒,是污染性的气体;
③铜与氧气反应生成CuO,2Cu+O2 ![]() 2CuO,氧化铜和硝酸反应生成硝酸铜和水,制备1molCu(NO3)2 , 需要2molHNO3 , 且没有生成污染性气体;
2CuO,氧化铜和硝酸反应生成硝酸铜和水,制备1molCu(NO3)2 , 需要2molHNO3 , 且没有生成污染性气体;
A.制取相同质量的硝酸铜,制备1molCu(NO3)2 , 生成相同质量的Cu(NO3)2 , ①需要1molCu,②需要1molCu,③需要1molCu,所以所消耗的铜的质量相等,故A正确;
B.制备1molCu(NO3)2 , 生成相同质量的Cu(NO3)2 , ①需要 ![]() molHNO3 , ②需要4molHNO3 , ③需要2molHNO3 , 途径②消耗HNO3最多,途径①次之,途径③消耗HNO3最少,故B错误;
molHNO3 , ②需要4molHNO3 , ③需要2molHNO3 , 途径②消耗HNO3最多,途径①次之,途径③消耗HNO3最少,故B错误;
C.由方程式通过比较可以看出,生成相同质量的Cu(NO3)2 , 铜与浓硝酸反应速率最快,但消耗的硝酸最多,且造成较大污染,途径③效果最佳,既不造成污染,又能提高HNO3的利用率,所以途径③的制备方法是最符合“绿色化学”理念,故C正确;
D.途径①中铜与稀硝酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,被氧化的铜与被还原的硝酸的物质的量比是3:2,故D正确;
故选B.

【题目】已知,常温下H2S、H2CO3 的电离常数如下表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常温下,0.1mol/L的硫化钠溶液和0.1mol.L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
② 常温下,硫化钠水解的离子方程式_____________________________。
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子。
①常温下,NaHS溶液显______(选填“酸性”、“中性”或“碱性”)
②常温下,向100 mL 0.1 mol·L-1 H2S溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
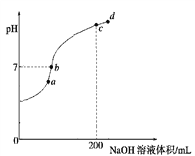
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)_______________;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是___________。