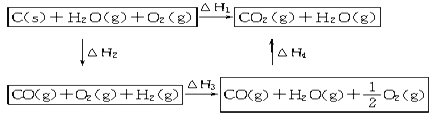
题目内容
【题目】A、B、C、D、E五种短周期元素的原子序数依次增大;A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素形成的某种单质是自然界中最硬的物质;A与D可以形成原子个数比分别为1:1和2 : 1的两种液态化合物;E的气态氧化物能使品红溶液褪色,加热品红恢复红色。请回答:
(1)E的原子结构示意图为_______________。
(2)可以验证B与E两元素非金属性强弱的方法是_________(填写字母序号)。
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的最高价氧化物对应水化物的酸性
C.比较只有这两种元素所形成的简单化合物中元素的化合价
(3)写出由A、C两种元素组成的原子个数比为2:1的化合物的电子式_________________。
(4)写出由A、B、C、D四种元素组成的离子个数比为1:1的化合物的化学式_______________。
(5) A分别与B、C、D形成的最简单化合物的稳定性由强到弱的顺序为______________(用化学式表示)。
(6)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程简述如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3混合溶液中,生成两种碱,写出该反应的总离子方程式______________________________________________。
②上述反应得到的两种碱在一定条件下继续作用得到Fe3O4,写出该反应的化学方程式______________________________________________。
(7)将8.4gFe加入某浓度的C的最高价氧化物对应水化物的溶液中,充分反应后,Fe无剩余(且滴加KSCN溶液无明显现象),生成标况下的CD和CD2两种气体共4.032L,其中含 CD________mol。
【答案】 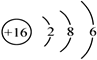 B 、C
B 、C ![]() NH4HCO3 (CH3COONH4或HCOONH4等) H2O > NH3 > CH4 Fe2++2Fe3++8NH3+8H2O=Fe(OH)2↓+2Fe(OH)3↓+8NH4+ Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O 0.06
NH4HCO3 (CH3COONH4或HCOONH4等) H2O > NH3 > CH4 Fe2++2Fe3++8NH3+8H2O=Fe(OH)2↓+2Fe(OH)3↓+8NH4+ Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O 0.06
【解析】A、B、C、D、E五种短周期元素的原子序数依次增大;A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素形成的某种单质是自然界中最硬的物质,B是C;A与D可以形成原子个数比分别为1:1和2:1的两种液态化合物,所以A是H,D是O,则C是N;E的气态氧化物能使品红溶液褪色,加热品红恢复红色,E是S。则
(1)S的原子结构示意图为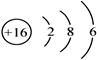 。(2)A.非金属性强弱与氢化物的沸点没有关系,A错误;B.非金属性越强,最高价含氧酸的酸性越强,则比较这两种元素的最高价氧化物对应水化物的酸性可以比较非金属性强弱,B正确;C.非金属性越强,越容易吸引共用电子对,因此比较只有这两种元素所形成的简单化合物中元素的化合价可以比较非金属性强弱,C正确,答案选BC;(3)由A、C两种元素组成的原子个数比为2:1的化合物是N2H4,属于含有共价键的共价化合物,电子式为
。(2)A.非金属性强弱与氢化物的沸点没有关系,A错误;B.非金属性越强,最高价含氧酸的酸性越强,则比较这两种元素的最高价氧化物对应水化物的酸性可以比较非金属性强弱,B正确;C.非金属性越强,越容易吸引共用电子对,因此比较只有这两种元素所形成的简单化合物中元素的化合价可以比较非金属性强弱,C正确,答案选BC;(3)由A、C两种元素组成的原子个数比为2:1的化合物是N2H4,属于含有共价键的共价化合物,电子式为![]() 。(4)由H、C、N、O四种元素组成的离子个数比为1:1的化合物可以是碳酸氢铵,化学式为NH4HCO3。(5)非金属性越强,氢化物越稳定,非金属性是O>N>C,则A分别与B、C、D形成的最简单化合物的稳定性由强到弱的顺序为H2O>NH3 >CH4。(6)①将化合物NH3通入等物质的量的FeSO4、Fe2(SO4)3混合溶液中,生成两种碱,应该是氢氧化铁和氢氧化亚铁,根据原子守恒可知该反应的总离子方程式为Fe2++2Fe3++8NH3+8H2O=Fe(OH)2↓+2Fe(OH)3↓+8NH4+。②上述反应得到的两种碱在一定条件下继续作用得到Fe3O4,根据原子守恒可知该反应的化学方程式为Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O。(7)8.4g铁的物质的量是8.4g÷56g/mol=0.15mol,充分反应后,Fe无剩余(且滴加KSCN溶液无明显现象),这说明生成物是亚铁离子。混合气体的物质的量是4.032L÷22.4L/mol=0.18mol,设NO和NO2的物质的量分别是xmol、ymol,则根据原子守恒和电子得失守恒可知x+y=0.18、3x+y=0.15×2,解得x=0.06,y=0.12。
。(4)由H、C、N、O四种元素组成的离子个数比为1:1的化合物可以是碳酸氢铵,化学式为NH4HCO3。(5)非金属性越强,氢化物越稳定,非金属性是O>N>C,则A分别与B、C、D形成的最简单化合物的稳定性由强到弱的顺序为H2O>NH3 >CH4。(6)①将化合物NH3通入等物质的量的FeSO4、Fe2(SO4)3混合溶液中,生成两种碱,应该是氢氧化铁和氢氧化亚铁,根据原子守恒可知该反应的总离子方程式为Fe2++2Fe3++8NH3+8H2O=Fe(OH)2↓+2Fe(OH)3↓+8NH4+。②上述反应得到的两种碱在一定条件下继续作用得到Fe3O4,根据原子守恒可知该反应的化学方程式为Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O。(7)8.4g铁的物质的量是8.4g÷56g/mol=0.15mol,充分反应后,Fe无剩余(且滴加KSCN溶液无明显现象),这说明生成物是亚铁离子。混合气体的物质的量是4.032L÷22.4L/mol=0.18mol,设NO和NO2的物质的量分别是xmol、ymol,则根据原子守恒和电子得失守恒可知x+y=0.18、3x+y=0.15×2,解得x=0.06,y=0.12。

 名校课堂系列答案
名校课堂系列答案