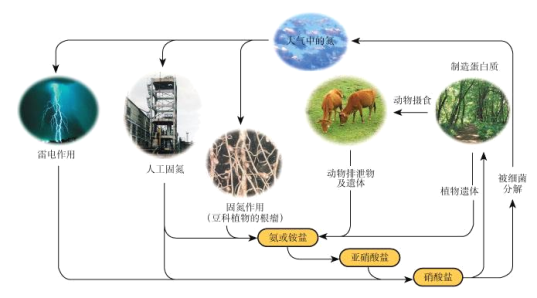
题目内容
【题目】在利用镁条与醋酸的反应研究化学反应速率的影响因素的实验中,同学们记录了相同体积、不同浓度的醋酸与足量Mg条反应,产生H2体积随时间变化的数据,并以单位时间内产生H2的体积来表示反应速率,其反应速率随时间变化的图(如图所示)。
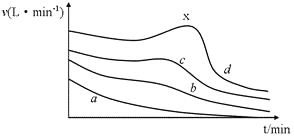
(1)在a、b、c、d四条曲线中,对应醋酸溶液的物质的量浓度最小的是_________,反应最后产生的H2在相同条件下体积最大的是_____________。
(2)在d曲线中,反应一段时间以后,反应速率出现反常的升高的现象(x点附近)。产生这种现象的原因主要是____________。
【答案】a d Mg和酸的反应是放热反应,反应过程中放出的热量将使溶液的温度升高
【解析】
对比四条曲线,可知在温度、压强均相同的时候,反应速率与反应物的浓度呈正比关系,即反应物浓度越高,反应速率越快。但由于Mg和酸的反应是放热反应,因此在b、c、d三根曲线上都能看出在反应过程中,随着反应放出的热量使溶液的温度升高,反应速率加快(x点附近);但随着反应的进行,反应物的浓度降低,反应速率将逐渐减慢。
(1)当恒T,恒P时,化学反应速率与反应物的浓度呈正比关系,即反应物浓度越小,反应速率越慢。在a、b、c、d四条曲线中,醋酸溶液的物质的量浓度最小对应着单位时间内产生H2的体积最小的a曲线。根据曲线可知,d曲线单位时间产生的H2体积最大。
(2) 由于Mg和酸的反应是放热反应,因此在反应过程中放出的热量将使溶液的温度升高,反应速率加快(x点附近)。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目