��Ŀ����
����Ŀ����ѧ�����ͨѶ����ͨ���ճ����������Ź㷺��Ӧ�á�
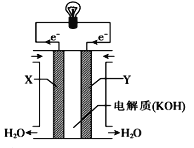
(1)��ͼΪ����ȼ�ϵ�صĹ���ʾ��ͼ���ɴ��ж�X��Ϊ��ص�_____����OH����______(���������)���������ƶ���Y���ĵ缫��Ӧ����ʽΪ________����·��ÿת��0.2mol���ӣ���״������������������������_______ L��
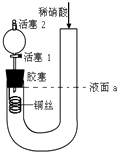
(2)Ϊ����֤Fe3 +��Cu2+������ǿ�������һ��װ�ã�����װ�ü��ܲ����������ܴﵽʵ��Ŀ�ĵ���__________��

(3)Ǧ�����dz����Ļ�ѧ��Դ֮һ�����硢�ŵ���ܷ�Ӧ�ǣ�2PbSO4 + 2H2O![]() Pb + PbO2 + 2H2SO4��Ǧ���طŵ�ʱ������______�������ʻ�ѧʽ�����õ缫����_____������ӡ����٣��������Һ���Ϊ2L����Ӧ������Һ����仯���Բ��ƣ����ŵ���������·��ת��3mol���ӣ�������Ũ����5mol/L�½���________mol/L��
Pb + PbO2 + 2H2SO4��Ǧ���طŵ�ʱ������______�������ʻ�ѧʽ�����õ缫����_____������ӡ����٣��������Һ���Ϊ2L����Ӧ������Һ����仯���Բ��ƣ����ŵ���������·��ת��3mol���ӣ�������Ũ����5mol/L�½���________mol/L��
���𰸡� �� �� O2��2H2O+4e��=4OH�� 1.12L B PbO2 ���� 3.5
��������(1)��������ԭ����ʧ���ӣ��Ǹ���,X��Ϊ��صĸ�����OH�����������ƶ���O2�õ��ӣ�Y���ĵ缫��Ӧ����ʽΪO2��2H2O+4e��=4OH������·��ÿת��0.2mol���ӣ���״������������������������0.2mol��22.4L��mol��1/4 =1.12L��(2)Ϊ����֤Fe3 +��Cu2+������ǿ�������ܲ����������ܴﵽʵ��Ŀ�ĵ���B��A��п��Fe3 +��Ӧ����A����B��Fe3 +��Cu��Ӧ������֤Fe3 +��Cu2+������ǿ������B��ȷ��C������Ũ���ᷴӦ����C����D�����缫��ͬ�������γ�ԭ��أ���D����ѡB��(3)PbO2����������Ǧ���طŵ�ʱ������PbO2�������ʻ�ѧʽ�����ŵ����PbSO4���õ缫�������ӡ������Һ���Ϊ2L����Ӧ������Һ����仯���Բ��ƣ���2PbSO4 + 2H2O![]() Pb + PbO2 + 2H2SO4��ÿת��2mol���ӣ�����2mol���ᣬ�ŵ���������·��ת��3mol���ӣ�����3mol���ᣬ������Ũ����5mol/L�½���
Pb + PbO2 + 2H2SO4��ÿת��2mol���ӣ�����2mol���ᣬ�ŵ���������·��ת��3mol���ӣ�����3mol���ᣬ������Ũ����5mol/L�½���![]() =3.5mol/L��
=3.5mol/L��