题目内容
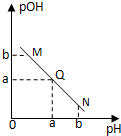
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-) )与pH的变化关系如图所示,则

A.N点所示溶液中c(H+) < c(OH-)
B.M点所示溶液导电能力强于Q点
C.M点水的电离程度大于N点
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
【答案】
A
【解析】
试题分析:向醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液的氢离子浓度逐渐减小,pOH减小。所以Q点溶液呈中性,M点溶液呈酸性,N点呈碱性。所以,A正确;B、Q点溶液强电解质溶液,M点溶液为弱酸,N点碱过量,所以导电能力N>Q>M;C、M点c(H+) = N点c(OH-),水的电离程度相同;D、Q点溶液呈中性,酸稍过量。
考点:考查水溶液中的离子平衡。

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )| A、M点所示溶液导电能力强于Q点 | B、N点所示溶液中c(CH3COO-)>c(Na+) | C、M点和N点所示溶液中水的电离程度相同 | D、Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-))与pH的变化关系如图所示,则( )
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-))与pH的变化关系如图所示,则( )| A、N点所示溶液中c(H+)<c(OH-) | B、M点所示溶液导电能力强于Q点 | C、M点水的电离程度大于N点 | D、Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |


