题目内容
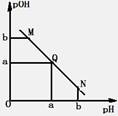
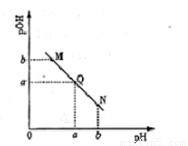
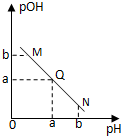
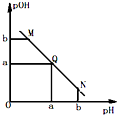 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )| A、M点所示溶液导电能力强于Q点 | B、N点所示溶液中c(CH3COO-)>c(Na+) | C、M点和N点所示溶液中水的电离程度相同 | D、Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
分析:酸溶液中pOH越大,说明溶液中氢氧根离子浓度越小,溶液氢离子浓度越大,酸性越强,随着NaOH的加入,发生中和反应,溶液氢氧根离子的浓度逐渐增大,则溶液pOH逐渐减小,pH逐渐增大,结合若电解质的电离解答该题.
解答:解:A.由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,故A错误;
B.N点所示溶液为碱性,根据溶液电荷守恒易判断出此时c(Na+)>c(CH3COO-),故B错误;
C.由于M点的H+浓度等于N点的OH-浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故C正确;
D.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性.则所加NaOH溶液体积略小于醋酸溶液的体积,故D错误.
故选C.
B.N点所示溶液为碱性,根据溶液电荷守恒易判断出此时c(Na+)>c(CH3COO-),故B错误;
C.由于M点的H+浓度等于N点的OH-浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故C正确;
D.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性.则所加NaOH溶液体积略小于醋酸溶液的体积,故D错误.
故选C.
点评:本题考查酸碱中和的定性判断和计算,侧重于弱电解质的电离的考查,注意弱电解质的电离特点,把握pOH的含义,题目难度中等.

练习册系列答案
相关题目
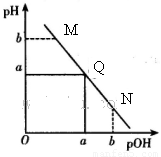
 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-))与pH的变化关系如图所示,则( )
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-))与pH的变化关系如图所示,则( )| A、N点所示溶液中c(H+)<c(OH-) | B、M点所示溶液导电能力强于Q点 | C、M点水的电离程度大于N点 | D、Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |