题目内容
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中错误的是
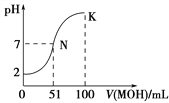
A. HA为一元强酸
B. MOH为一元弱碱
C. N点水的电离程度大于K点水的电离程度
D. K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol·L-1
【答案】D
【解析】A、起点时pH=2,c(H+)=10-2mol·L-1,HA的浓度为0.01mol·L-1,即HA为强酸,故说法正确;B、加入50mL的MOH时,两者恰好完全反应,此时溶液显酸性MA属于强酸弱碱盐,即MOH是弱碱,故说法正确;C、K点溶液中MOH的物质的量大于N点时MOH的物质的量,对水的电离抑制增强,故说法正确;D、K点溶质为MOH和MA,且两者物质的量相等,根据电荷守恒,得出c(M+)+c(H+)=c(A-)+c(OH-),根据物料守恒,c(M+)+c(MOH)=2c(A-),两式变形,得到c(MOH)+2c(OH-)-2c(H+)=c(M+),即c(MOH)+c(OH-)-c(H+)=c(M+)+c(H+)-c(OH-)=c(A-)=0.01/2mol·L-1=0.005mol·L-1,故说法错误。

【题目】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯。


熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | -97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
有关数据如表所示,请回答下列问题:
(1)在烧瓶中混合有机物及浓硫酸的方法是___________________,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时。
(2)B装置的冷凝管的主要作用是_____________,可否换为球形冷凝管(填“可”或“否”)。
(3)制备和提纯苯甲酸甲酯的操作先后顺序为_______________(填装置字母代号)。
(4)A中Na2CO3的作用是____________________;D装置的作用是___________________
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出