��Ŀ����
����Ŀ���ѣ�Ti������Ϊ��������֮��ĵ����������Ѱף�TiO2����Ŀǰ��õİ�ɫ���ϡ��Ʊ�TiO2��Ti��ԭ�����������ҹ�������������������λ������Fe2O3����������Ҫ�ɷ�ΪFeTiO3����ȡTiO2���������£�
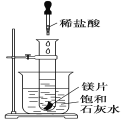
��1��Ti��ԭ������Ϊ22��λ��Ԫ�����ڱ��е�_________���ڵ�___________�塣
��2��������������Ŀ����___________________���������ȴ��Ŀ����__________��
��3��д������������H2TiO3�����ӷ���ʽ__________________________________��
��4�������Ʊ�TiO2�Ĺ����У����dzɱ��ͷ����ۺ��������أ���Һ��Ӧ����______������
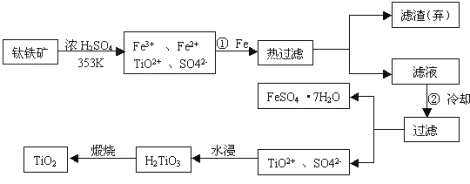
��5���ɽ��ʯ(TiO2 )��ȡ����Ti���漰���IJ���Ϊ��TiO2��TiCl4![]() Ti
Ti
��֪���� C(s) + O2 (g) = CO2 (g) ��H = ��393.5 kJmol-1
�� 2CO(g) + O2 (g) = 2CO2(g) ��H =��566 kJmol-1
�� TiO2 (s) + 2Cl2 (g) = TiCl4 (s) + O2 (g) ��H = +141kJmol-1
��TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g) ����H =___________����ӦTiCl4+2Mg=2MgCl2+Ti��Ar�����н��е�������_____________________��
���𰸡��� ��B ��Fe3+��ԭΪFe2+ ����FeSO47H2O TiO2++2H2O H2TiO3+2H+ ��ʯ�ң�����ʯ�ҡ�̼��ơ��ϼ ��80kJmol��1 ��ֹ������Mg��Ti������е�O2����CO2��N2������
��������
���۵������ɲ���ٵ�ǰ���Լ�������ò����е�FeSO47H2O���������ѵó���Ϊ�˳�ȥ�����Һ�е�Fe3+���������ȴ��Ŀ���ɲ������˺͵õ���������FeSO47H2O�ɵã���Ϊ����FeSO47H2O���ܽ�ȣ����������У��������õĸ�����Ҳ�ɴӷ�Ӧ�������ַ���ΪFeSO47H2O��CO��MgCl2��Mg�ǻ��ý�������������ж������ʷ�Ӧ����˿ɵó�Ar������Ϊ����������ֹMg�Ϳ��������ʷ�Ӧ��ͼʾˮ����������H2TiO3ͬʱ���ɵ�H2SO4��Һ��TiOSO4+2H2O=H2TiO3+H2SO4����Ӧ����������ʴ���������˹���ɣ�������֪�٣��ڿ������2C(s)+O2(g)=2CO(g)����H=2��(-393.5)+566=-221 kJmol-1���ɴ˽�Ϣۿ��������H=-221+141=-80 kJmol-1���ݴ˴��⡣
��1��Tiλ��Ԫ�����ڱ��е���������B�壻
��2����������۵�������Ϊ�˳�ȥ�����Һ�е�Fe3+���������ȴ��Ŀ���ɲ������˺͵õ���������FeSO47H2O�ɵã���Ϊ����FeSO47H2O���ܽ�ȣ�
��3��ͼʾˮ����������H2TiO3ͬʱ���ɵ�H2SO4��Һ(TiOSO4+2H2OH2TiO3+H2SO4)�����ӷ���ʽTiO2++2H2O H2TiO3+2H+��
��4��ͼʾˮ����������H2TiO3ͬʱ���ɵ�H2SO4��Һ(TiOSO4+2H2O=H2TiO3+H2SO4)��Ӧ����������ʴ�����������ʯ��(��̼��ơ��ϼ�)��
��5������˹���ɣ�����+����2�ڿɵã�TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)����H=(+141kJmol1)+2��(393.5kJmol1)(566kJmol1)=80kJmol1��Mg�ǻ��ý�������������ж������ʷ�Ӧ����˿ɵó�Ar������Ϊ����������ֹMg�Ϳ��������ʷ�Ӧ��

����Ŀ����84������Һ(��ҵ����Cl2��NaOH��Ӧ�Ƶã�������������Ư�ף�����ʵ������ķ�������ȷ����
ʵ����� |
|
|
|
ʵ������ | ��Ϻ���Һ��pH=9.9,��ʱ����δ��ɫ��һ��ʱ�����ɫ��ȥ�� | ��Ϻ���ҺpH=5.0����ɫѸ����ȥ������������� | ��Ϻ���ҺpH=3.2����ɫѸ����ȥ���������������壬ʹʪ��ĵ��۵⻯����ֽ������ |
A.�Ա�ʵ����������������ɫѸ����ȥ��ԭ���Ƿ����˷�ӦClO+H+�THClO
B.ʵ�����в�����������Cl2����HClO�ֽ�õ���2HClO�TCl2��+H2O
C.�Ա�ʵ������������Һ��pH���ܻ�Ӱ��ClO�������Ի�Cl�Ļ�ԭ��
D.������������84������Һ��Ư��Ч��������Ҫ���غ��ʵ�pH���ܰ�ȫʹ��
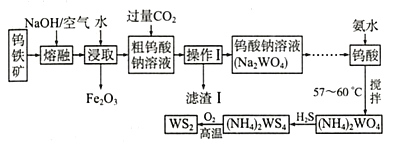
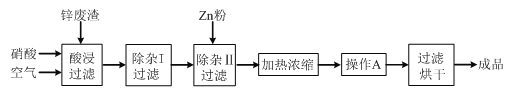
����Ŀ����ҵ�ϳ�����ұ��п�����е�п������ZnO��FeO��Fe2O3��CuO��Al2O3�����ʣ�������������Zn(NO3)2��6H2O���壬�乤������Ϊ��
�й��������↑ʼ�����ͳ�����ȫ��pH���±���
�������� | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
��ʼ������pH | 3��3 | 1��5 | 6��5 | 4��2 | 5��4 |
������ȫ��pH | 5��2 | 3��7 | 9��7 | 6��7 | 8��0 |
���ڡ�����������У�Ϊ���п�Ľ������ʣ���ͨ����������衱�⣬���ɲ�ȡ�Ĵ�ʩ��_____________________��
���������������жദ�漰�����ˡ���ʵ�����й��˲�����Ҫʹ�õIJ���������_____��
���ڡ�����I�������У����ټ�������H2O2��Һ��H2O2��Fe2+��Ӧ�����ӷ���ʽΪ_____��ΪʹFe(OH)3��Al(OH)3������ȫ����Zn(OH)2��������Ӧ������Һ��pH��ΧΪ_____������Fe3+�Ƿ������ȫ��ʵ�������_____��
�ȼ���Zn�۵�������_____��������A����������_____��