题目内容
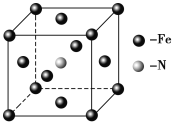
【题目】三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:

(1)Se是S的下一周期同主族元素,其核外电子排布式为____________;
(2)第一电离能:S_______ (填“>”“<”或“=”,下同)P;电负性:S________P。
(3)三硫化四磷分子中P原子采取________杂化,与PO3-互为等电子体的化合物分子的化学式为______。
(4)二硫化碳属于__________(填“极性”或“非极性”)分子。
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_____。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是_______。
(7)氢氧化钠具有NaCl型结构,其晶饱中Na+与OH-之间的距离为acm,晶胞中Na+的配位数为__________,用NA表示阿伏加德罗常数的数值,NaOH的密度为___________g·cm-3。
【答案】 [Ar]3d104s24p4(或1s22s22p63s23p63d104s24p4) < > sp3 SO3 非极性 NA HN3分子间存在氢键 6 20/(a3NA)
【解析】(1)Se是S的下一周期同主族元素,其核外电子排布式为[Ar]3d104s24p4;
(2)同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于相邻元素;同一主族元素中,元素的第一电离能随着原子序数的增大而减小;同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,第一电离能:S<P;电负性:S>P;
(3)P4S3中P原子成3个P-S键、含有一对孤对电子,杂化轨道数为4,P原子采取sp3杂化;与PO3-互为等电子体的化合物分子的化学式为SO3;
(4)二硫化碳与二氧化碳的结构相似,正负电荷中心重合,属于非极性分子;
(5)根据图知,每个P上1对孤对电子对,每个S有2对孤对电子对,1mol共10对孤对电子对,0.1mol含有NA孤对电子对数;
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是HN3分子间存在氢键,使沸点反常的升高;
(7)以体心Na+研究,与之相邻的Cl-位于面心,晶胞中Na+的配位数为6,晶胞中Na+与Cl-之间的距离为a cm,则晶胞棱长为2a cm,晶胞体积为(2a cm)3,晶胞中Na+离子数目为1+12×![]() =4、Cl-离子数目为8×
=4、Cl-离子数目为8×![]() +6×
+6×![]() =4,则晶胞质量为4×
=4,则晶胞质量为4×![]() g,则晶胞密度为4×
g,则晶胞密度为4×![]() g÷(2a cm)3=
g÷(2a cm)3=![]() g.cm-3。
g.cm-3。

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”);