题目内容
(16分)在一容积为2 L的密闭容器内加入0.2 molA和0.6 molB,在一定条件下发生反应:A(s)+3B(g) 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
⑴该反应的平衡常数表达式K= ,ΔH 0(填“>”或“<”)。
⑵1000 ℃时,4 min后达到平衡.求4 min内D的平均反应速率v(D)= ,B的平衡转化率为 ,平衡时B的体积分数 。
⑶欲提高⑵中B的平衡转化率,可采取的措施是
A.减少C的量 B.增加A的量 C.移出部分D
D.降低反应温度 E.减小容器的容积 F.加入合适的催化剂
⑷1000 ℃时, 在一容积为2 L的密闭容器内加入XmolC和0.6 molD,5 min后达到平衡,B的浓度与⑵中B的浓度相同,求X的范围
⑸下列说法中能说明反应已达到平衡状态的是
A.容器内混合气体的压强不随时间变化而变 B.B的速率不随时间的变化而变化
C.c(B)︰c(D)=1︰1 D.混合气体的密度保持不变(M(B)≠M(D))
⑴c3(D) / c3(B) ;< ;⑵ 0.06 mol·L-1·min-1;80% ;20% ⑶ CD ;⑷ >0.08 ;⑸ BD 。
解析试题分析:根据化学平衡常数的定义可得K= c3(D) / c3(B)。由于升高温度,平衡常数减小。说明升高温度,化学平衡向逆反应方向移动。逆反应方向为吸热反应,所以该反应的正反应为放热反应。因此ΔH<0. ⑵1000 ℃时,4 min后达到平衡.假设达到平衡时生成D的物质的量浓度为x,则消耗B的物质的量浓度也是x.平衡时B的浓度为(0.3-x)mol/L.x3/(0.3-x)3=64.0。解得x=0.24mol/L.则4 min内D的平均反应速率v(D)=0.24mol/L÷4min=0.06mol/(L·min)。B的转化率为(0.24mol/L÷0.3mol/L)×100%=80%. 因为在反应达到平衡时B的物质的量浓度为(0.3-x)mol/L=(0.3-0.24)mol/L=0.06mol/L该反应是个反应前后气体体积相等的反应,元素平衡时B的体积分数(0.06mol/L÷0.3mol/L)×100%=20%. ⑶A.由于C是固体,所以减少C的量,对化学平衡的移动无影响。错误。B.由于A的状态是固体,所以增加A的量,平衡不移动,错误。C.移出部分D,加成生成物的浓度,平衡正向移动,B的平衡转化率提高。正确。D.降低反应温度,平衡正向移动,B的平衡转化率提高。正确。E.减小容器的容积,因为该反应是反应前后气体体积相等的反应,所以改变压强,化学平衡不移动。错误。F.加入合适的催化剂,正反应、逆反应的速率加快,但是平衡不发生移动。错误。因此正确选项为CD。(4)在反应开始时c(D)=0.3mol/L.当反应达到平衡后,c(B)= 0.06mol/L,因为在方程式中B、D的系数相同,因此D的平衡浓度为c(D)(平衡)=0.24mol/L.由于在化学方程式A(s)+3B(g)  2C(s)+3D(g)中C:B=2:3,所以消耗的C的物质的量为0.06mol/L×2L×2/3=0.08mol。该反应为可逆反应,当达到平衡后还应该存在C物质。因此开始时加入的C的物质的量应该比0.08mol多。即X>0.08mol。⑸A.由于该反应是反应前后气体体积相等的可逆反应,无论反应是否达到平衡,容器内混合气体的压强都不随时间变化而变。错误。B.因为B是气态物质。若它的速率不随时间的变化而变化,说明其浓度不再发生变化,反应达到平衡。正确。C.由于在方程式中二者的系数相同,所以任何时刻c(B)︰c(D)=1︰1。不能说明反应达到平衡状态。错误。D.因为参加反应的物质有固体,而且M(B)≠M(D)。若反应达到平衡状态,各种气体的质量不变,总质量不变,混合气体的密度保持不变;若反应未达到平衡,则混合气体的质量就要发生变化,则混合气体的密度就要发生变化,因此该项内容能作为反应达到平衡的标志。正确。
2C(s)+3D(g)中C:B=2:3,所以消耗的C的物质的量为0.06mol/L×2L×2/3=0.08mol。该反应为可逆反应,当达到平衡后还应该存在C物质。因此开始时加入的C的物质的量应该比0.08mol多。即X>0.08mol。⑸A.由于该反应是反应前后气体体积相等的可逆反应,无论反应是否达到平衡,容器内混合气体的压强都不随时间变化而变。错误。B.因为B是气态物质。若它的速率不随时间的变化而变化,说明其浓度不再发生变化,反应达到平衡。正确。C.由于在方程式中二者的系数相同,所以任何时刻c(B)︰c(D)=1︰1。不能说明反应达到平衡状态。错误。D.因为参加反应的物质有固体,而且M(B)≠M(D)。若反应达到平衡状态,各种气体的质量不变,总质量不变,混合气体的密度保持不变;若反应未达到平衡,则混合气体的质量就要发生变化,则混合气体的密度就要发生变化,因此该项内容能作为反应达到平衡的标志。正确。
考点:考查平衡常数表达式、反应热的判断、化学反应速率的计算、平衡时物质的转化率及含量的计算、提高反应物转化率的措施、化学平衡状态的判断的知识。

(5分)氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
(1)右图表示温度为T K时氮气与氢气合成氨反应过程中的能量变化, 写出该反应的热化学方程式 。
(2)已知在TK温度下合成氨反应在2.00L的密闭容器中进行。得到如下数据:
| 时间(h) 物质的量(mol) | | 0 | 1 | 2 | 3 | 4 |
| N2 | | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①0~1h内N2的平均反应速率为mol/(L·h)。
②反应进行到2h时放出的热量为 kJ。
③此条件下,反应:N2 + 3H2
 2NH3的化学平衡常数K = (保留两位小数)。
2NH3的化学平衡常数K = (保留两位小数)。④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡移动的方向是 (填“正反应”或“逆反应”或“不移动”)。
.(16分)Ⅰ.已知下列反应的热化学方程式为:
(1) C(s) + O2(g) = CO2(g) △H1 =" -393.5" kJ/mol
(2) CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l) △H2 =" -870.3" kJ/mol
(3) 2H2(g) + O2(g) = 2H2O(l) △H3 =" -571.6" kJ/mol
请计算:2C(s) + 2H2(g) + O2(g)= CH3COOH(l) △H4 = 。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2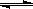 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L)。反应在前10min内的平均速率为ν(t-BuNO)= 。列式计算上述反应的平衡常数K = 。
(2)有关反应:(t-BuNO)2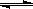 2(t-BuNO) 的叙述正确的是( )
2(t-BuNO) 的叙述正确的是( )
A.压强越大,反应物的转化率越大 B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。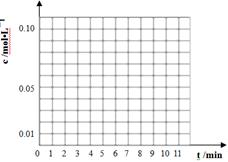
| 时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
| c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
| c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.07 | 0.094 | 0.096 | 0.096 |
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出大试管中发生反应的化学方程式: ,该反应是 反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与 有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行, 在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
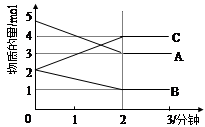
(3)该反应的的化学方程式为 ;
(4)反应开始至2分钟时,B的平均反应速率为 。
(5)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B) b.容器内压强保持不变
c.v逆(A)= v正(C) d.容器内混合气体的密度保持不变
(6)由图求得A的平衡时的转化率为 。
碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32- 2I-+ S4O62-(快)
2I-+ S4O62-(快)
向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx mL,理由是 。
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)

碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:2Li(s)+I2(s)
 2LiI(s)ΔH
2LiI(s)ΔH已知:①4Li(s)+O2(g)
 2Li2O(s) ΔH1 ②4LiI(s)+O2(g)
2Li2O(s) ΔH1 ②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2则电池反应的ΔH= ;碘电极作为该电池的 极。
一定条件下,体积为1 L的密闭容器中发生如下反应:SiF4(g)+2H2O(g) SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填序号)。
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大
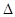 H=-1266.8kJ·mol-1
H=-1266.8kJ·mol-1
 2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。
 Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
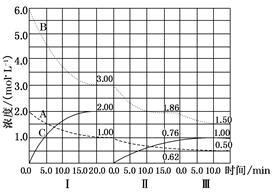
LiMnO4 + C cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示: