��Ŀ����
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��H2��g��+ ![]() O2��g���TH2O��l����H=��285.8kJmol��1
O2��g���TH2O��l����H=��285.8kJmol��1
��H2��g��+ ![]() O2��g���TH2O��g����H=��241.8kJmol��1
O2��g���TH2O��g����H=��241.8kJmol��1
��C��s��+ ![]() O2��g���TCO��g����H=��110.5kJmol��1
O2��g���TCO��g����H=��110.5kJmol��1
��C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
�ش����и����⣺
��1��������Ӧ�����ڷ��ȷ�Ӧ���� ��
��2��H2��ȼ����Ϊ��C��ȼ����Ϊ ��
��3��ȼ��10g H2����Һ̬ˮ���ų�������Ϊ ��
��4��COȼ�յ��Ȼ�ѧ����ʽΪ����ȼ���ȡ�HΪ ��
���𰸡�
��1���٢ڢۢ�
��2��285.8kJ?mol��1��393.5kJ?mol��1
��3��1429.0kJ
��4��CO��g��+O2��g���TCO2��g����H=��283.0kJ?mol��1����283.0kJ?mol��1
���������⣺��1�����ʵ�ȼ�վ�Ϊ���ȷ�Ӧ�����٢�Ϊ������ȼ�գ��ۢ�ΪC��ȼ�գ��ʢ٢ڢܾۢ�Ϊ���ȷ�Ӧ�����Դ��ǣ��٢ڢۢܣ���2��ȼ������ָ��101kPʱ��1mol��ȼ����ȫȼ�������ȶ���������ʱ���ų���������CԪ��ת��ΪCO2 �� HԪ��ת��ΪҺ̬ˮ���ʷ�Ӧ��Ϊ������ȼ���ȵ��Ȼ�ѧ����ʽ����������ȼ����Ϊ285.8kJmol��1����Ӧ��ΪC��ȼ���ȵ��Ȼ�ѧ����ʽ����C��ȼ����Ϊ393.5kJmol��1 �� ���Դ��ǣ�285.8 kJmol��1��393.5kJmol��1����3��10g���������ʵ���Ϊ5mol����1mol����ȼ������Һ̬ˮʱ�ų�285.8KJ����5mol����ȼ������Һ̬ˮʱ�ų�������Ϊ285.8kJmol��1��5mol=1429.0 kJ�����Դ��ǣ�1429.0kJ�� ��4�����ݸ�˹���ɿ�֪�����ܩ��ۿɵ�CO��ȼ�շ�ӦΪ��CO��g��+O2��g���TCO2��g����H=��283.0 kJmol��1 �� ��CO��ȼ���ȡ�HΪ��283.0 kJmol��1 �� ���Դ��ǣ�CO��g��+O2��g���TCO2��g����H=��283.0 kJmol��1����283.0 kJmol��1 ��
�����㾫����ͨ������������ȷ�Ӧ�ͷ��ȷ�Ӧ�ͷ�Ӧ�Ⱥ��ʱ䣬���ջ�ѧ�ϰ����������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ����ѧ�ϰѷų������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ���ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȼ����Խ����⣮

����Ŀ�������������ʵ���Ҫ���������ʽṹ����ش��������⡣
��1����֪A��BΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
������/kJ��mol��1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
Aͨ�����ۣ�BԪ�صĺ�������Ų�ʽΪ��
��2������Ϊ300nm�����Ĺ��������е�����ԼΪ399 kJ��mol��1�������±��йص����ʷ�������Ҫ��ѧ������Ϣ��˵�����峤ʱ������������Ƥ�������˺���ԭ��������ɵ����ʵ���İ������е�̼ԭ���ӻ���������
���ۼ� | C��C | C��N | C��S |
����/ kJ��mol��1 | 347 | 305 | 259 |
��3��ʵ��֤����KCl��MgO��CaO��TiN��4�־���Ľṹ
��NaCl����ṹ���ƣ�����ͼ��ʾ������֪3�����Ӿ���ľ������������±���
���Ӿ��� | NaCl | KCl | CaO |
������/kJ��mol��1 | 786 | 715 | 3401 |
���4�����Ӿ��壨������NaCl���۵�Ӹߵ��͵�˳����������MgO������һ��Mg2����Χ�������ڽ��ҵȾ����Mg2��������
��4�����������Ӻ�δ�ɶԵ���Խ�࣬�����Խ�ż�¼����Խ�á�������������V2O5��CrO2�У��ʺ���¼�����ŷ�ԭ�ϵ�����
��5��ij�����ķ��ӽṹ����ͼ��ʾ��������ڲ�����������ţ���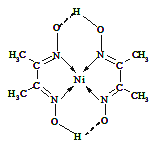
A.���Ӽ�
B.���Լ�
C.������
D.���
E.���
F.�Ǽ��Լ�






