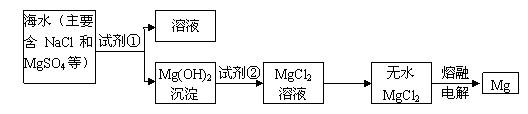题目内容
I、镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
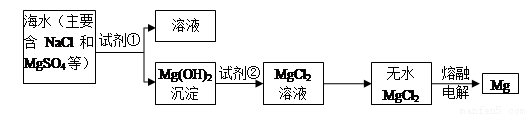
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用 ,要使MgSO4完全转化为
沉淀,加入试剂的量应为 。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是 。
(3)试剂②选用 ;写出其反应的离子方程式 。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为 。
Ⅱ.关于《必修2》中提到的常见有机物,请回答下列问题:
(1)苯在常温常压下呈 态。
(2)常温常压下气态直链烷烃含碳原子数≤ 。
(3)苯和甲烷中含碳量较高的是 。
(4) 写出苯与浓硝酸、浓硫酸混合液加热反应的化学方程式(用结构简式书写) 。
(5) 写出乙醇和乙酸的酯化反应方程式 。
(每空2分,共22分)I、 (1)氢氧化钙或生石灰,过量 (2)过滤
(3)盐酸;2 H+ +
Mg(OH)2=2H2O + Mg2+ (4)
MgCl2(熔融) Mg + Cl2↑
Mg + Cl2↑
II.(1)液(2)4 (3)苯 (4) 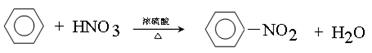
(5) CH3COOH+CH3CH2OH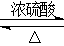 CH3COOCH2CH3
+H2O
CH3COOCH2CH3
+H2O
【解析】
试题分析:I、(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用廉价的氢氧化钙或生石灰。要使MgSO4完全转化为沉淀,加入试剂的量应为过量的。
(2)氢氧化镁不溶于水,分离得到Mg(OH)2沉淀的方法是过滤。
(3)氢氧化镁转化为氯化镁应该用盐酸,反应的离子方程式是2H+ + Mg(OH)2=2H2O + Mg2+ 。
(4)镁是活泼的金属,应该用电解法冶炼,反应的化学方程式是 MgCl2(熔融) Mg + Cl2↑。
Mg + Cl2↑。
Ⅱ. (1)苯在常温常压下呈液态。
(2)常温常压下气态直链烷烃含碳原子数≤4,即甲烷、乙烷、丙烷和丁烷。
(3)苯和甲烷中含碳量较高的是甲苯,甲烷是含氢量最高的烃。
(4)苯与浓硝酸、浓硫酸混合液加热发生取代反应生成硝基苯,反应的化学方程式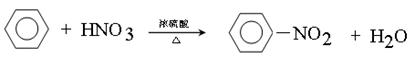 。
。
(5)乙醇和乙酸发生酯化反应生成乙酸乙酯,反应的化学方程式是CH3COOH+CH3CH2OH CH3COOCH2CH3
+H2O。
CH3COOCH2CH3
+H2O。
考点:考查海水中提取镁的有关判断、常见有机物结构、性质的有关判断以及方程式的书写
点评:该题紧扣教材基础知识,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于提高学生的应试能力,也有助于培养学生的规范答题能力,难度不大,记住并熟练应用即可。

 初中暑期衔接系列答案
初中暑期衔接系列答案