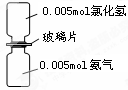
题目内容
设NA为阿伏加德罗常数,下列说法正确的是( )
| A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
| B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L |
| C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA |
| D.100ml1mol/LAlCl3溶液中含的阳离子数为0.1NA |
A
试题分析:A. 无论是S2还是S8都是由S原子构成的。n(S)=m/M=6.4g÷32g/mol=0.2mol.所以所含硫原子数一定为0.2NA。正确。B.二者会发生反应:NH3+HCl= NH4Cl. NH4Cl是固态物质。若混合时物质的量之比为1:1,则反应后无气体。若混合时物质的量的比不是1:1.则混合后的气体体积为反应过量的气体的物质的量所具有的体积,一定小于22.4L。错误。C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,氯元素的化合价从KClO4中的+7→Cl2中的0价,化合价降低了7价,得到了7mol电子,同时产生4molCl2。即每生成4molCl2转移的电子数为7NA.错误。D.在溶液中n(AlCl3)=0.1L×1mol/L=0.1mol.因为Al3+会发生水解反应:Al3++3H2O
 Al(OH)3+3H+.每有1个Al3+水解,就会产生3个H+离子。所以含有的阳离子数>0.1NA。错误。
Al(OH)3+3H+.每有1个Al3+水解,就会产生3个H+离子。所以含有的阳离子数>0.1NA。错误。
练习册系列答案
相关题目
 2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算: