题目内容
17.工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别.路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.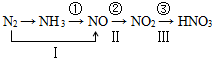
(1)写出工业制硝酸各步反应化学方程式4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO.
(2)硝酸生产排放出的NO是污染物,有一治理法,是在4000C且有催化剂作用下,用氨把NO还原成无色无味气体,其化学方程式为4NH3+6NO═5N2+6H2O.
分析 (1)工业上争取硝酸的反应有:氨气与氧气反应生成一氧化氮和水、一氧化氮与氧气反应生成二氧化氮、二氧化氮与水反应生成硝酸和一氧化氮,据此写出反应的化学方程式;
(2)在4000C且有催化剂作用下,用氨把NO还原成无色无味气体,该气体为氮气,根据氧化还原反应中化合价升降相等配平该化学方程式.
解答 解:(1)路线①②③是工业生产硝酸的主要途径,反应①是氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O;
反应②为NO与氧气反应生成二氧化氮,反应的化学方程式为:2NO+O2=2NO2;
反应③是二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式为:3NO2+H2O=2HNO3+NO,
故答案为:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO;
(2)在400℃且有催化剂作用下,用氨把NO还原成无色无味气体,根据化合价变化可知生成的气体为氮气,反应的化学方程式为:4NH3+6NO═5N2+6H2O,
故答案为:4NH3+6NO═5N2+6H2O.
点评 本题考查了含氮物质的应用,题目难度中等,明确工业制取硝酸的原理为解答关键,注意掌握含氮物质的性质及综合应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列有关元素化合物的叙述中正确的是( )
| A. | 碱金属原子的最外层电子数都是1,次外层电子数都是8 | |
| B. | 将SO2通入滴有紫色石蕊试液的水中,溶液变成红色 | |
| C. | 白磷易溶于水,不能保存在水中 | |
| D. | 高性能通信材料光 导纤维的主要原料是单品硅 |
8.根据要求完成下列各小题实验目的.(a、b为弹簧夹,加热及固定装置已略去)
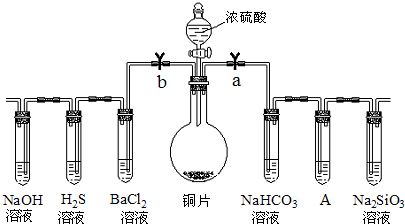
(1)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①接仪器并检查装置气密性、加药品后,打开a关闭 b,然后滴入浓硫酸,加热.
②铜与浓硫酸反应的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
装置A中的试剂可以是:品红溶液.
③能说明碳的非金属性比硅强的实验现象是:A中品红没有褪色,盛有Na2SiO3溶液的试管中出现白色沉淀.
(2)验证 SO2的氧化性、还原性和酸性氧化物的通性.
①打开b,关闭a.
②H2S溶液中有浅黄色浑浊出现,化学方程式是:2H2S+SO2=3S↓+2H2O
③BaCl2溶液中无明显现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填人下表相应位置:
写出SO2与氯水反应的离子方程式Cl2+SO2+2H2O=SO42-+4H++2Cl-.

(1)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①接仪器并检查装置气密性、加药品后,打开a关闭 b,然后滴入浓硫酸,加热.
②铜与浓硫酸反应的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
装置A中的试剂可以是:品红溶液.
③能说明碳的非金属性比硅强的实验现象是:A中品红没有褪色,盛有Na2SiO3溶液的试管中出现白色沉淀.
(2)验证 SO2的氧化性、还原性和酸性氧化物的通性.
①打开b,关闭a.
②H2S溶液中有浅黄色浑浊出现,化学方程式是:2H2S+SO2=3S↓+2H2O
③BaCl2溶液中无明显现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填人下表相应位置:
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | BaSO4 | BaSO3 |
5.下列各组物质混合后,既产生无色气体,又生成白色沉淀的是( )
| A. | Ba(NO3)2溶液和Na2SO4溶液 | B. | 金属钠和MgCl2溶液 | ||
| C. | 金属铝和NaOH溶液 | D. | 盐酸和NaOH溶液 |
12.为了更简便制取干燥的NH3,下列方法中合适的是( )
| A. | 氯化铵与浓硫酸混合加热,生成的气体用碱石灰进行干燥 | |
| B. | N2与H2在一定条件下化合成NH3,用烧碱干燥 | |
| C. | 加热浓氨水,气体用碱石灰干燥 | |
| D. | 加热NH4HCO3,气体用P2O5干燥 |
2.用NA表示阿弗加德罗常数,下列说法正确的是( )
| A. | 0.2 mol H2O2完全分解转移的电子数为0.4NA | |
| B. | 300 mL 2 mol•L-1的蔗糖溶液中所含分子数为0.6NA | |
| C. | 在标准状况下,2.8g N2和2.8g CO所含电子数均为1.4NA | |
| D. | 在常温常压下,2.24L SO2与O2混合气体中所含氧原子数为0.2NA |
9.将铝粉投入到下列溶液中,能观察到有气体产生的是( )
| A. | 自来水 | B. | 氯化钠溶液 | C. | 浓氢氧化钠溶液 | D. | 稀氨水 |
6.下列实验用来证明SO2的存在,其中正确的是( )
| A. | 能使品红褪色,加热后又出现红色 | |
| B. | 能使湿润的蓝色石蕊试纸变红 | |
| C. | 通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 | |
| D. | 通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀生成,且该沉淀不溶于硝酸 |
7.按硫元素的化合价由低到高的顺序排列的物质为:KHS、S、M、Al2(SO4)3、,其中物质M可能是( )
| A. | H2S | B. | Na2SO4 | C. | SO3 | D. | SO2 |