题目内容
【题目】常温下,用0.100 molL-1的NaOH溶液分别滴定20.00mL0.100molL-1盐酸和HA溶液,滴定曲线如图所示。下列说法错误的是
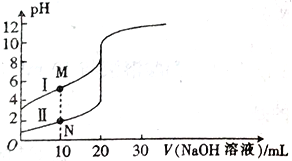
A. I表示的是HA溶液的滴定曲线 B. M点溶液中的c(A-)小于N点溶液中的c(Cl-)
C. HA的电离平衡常数K≈1.0×10-6 D. 曲线Ⅱ可选用甲基橙作为指示剂
【答案】C
【解析】A、盐酸属于强酸,常温下0.100mol·L-1盐酸的pH=1,即II为盐酸的滴定曲线,I为HA为滴定曲线,故A说法正确;B、M点的pH大于N点,M点的c(H+)小于N点的c(H+),即M点的c(A-)小于N点的c(Cl-),故B说法正确;C、电离平衡常数只受温度的影响,Ka=c(H+)×c(A-)/c(HA),根据图像,点M:c(H+)=10-5mol·L-1,c(A-)约等于10×10-3×0.1/30×10-3mol·L-1,c(HA)约为(20×10-3×0.1-10×10-3×0.1)/30×10-3mol·L-1,代入Ka的表达式,即Ka约为10-5,故C说法错误;D、用强碱滴定强酸可以用甲基橙作指示剂,也可以用酚酞作指示剂,故D说法正确。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:已知:H2的燃烧热为285.8 kJmol﹣1
N2(g)+2O2(g)═2NO2(g)△H=+133kJmol﹣1
H2O(g)═H2O(l)△H=﹣44kJmol﹣1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为______________。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
(1)①已知该反应能自发进行,则△H____0(填“大于”、“小于”或“等于”)
②如图,t2时CO2的转化率=_____________
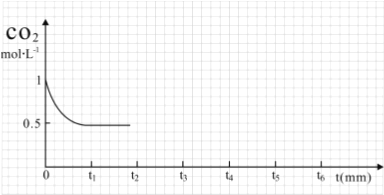
(2)改变温度,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质
都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)______K(Ⅱ)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(Ⅰ)______c(Ⅱ).
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=______,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1______T2(填“>”、“<”或“=”).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡______移动(填“正向”、“逆向”或“不”).