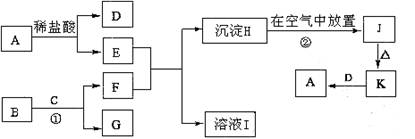
题目内容
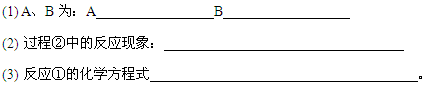
(14分))某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。
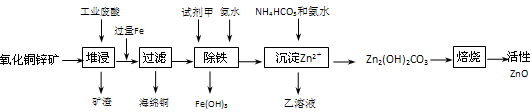
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方
程式 。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __ mol/L以下。
[Fe(OH)3的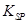 = 2.70×10-39]
= 2.70×10-39]
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式 。

已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方
程式 。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __ mol/L以下。
[Fe(OH)3的
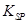 = 2.70×10-39]
= 2.70×10-39](6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式 。
(14分)
(1)< (2分)
(2)B C (2分)
(3)3.2~6.2 (2分)
(4)Fe3++3NH3·H2O ="==" Fe(OH)3↓+3 NH4+ (2分)
(5)2.7×10-21 (2分)
(6)(NH4)2SO4 (2分)
(7)2ZnSO4 +NH4HCO3 +3 NH3·H2O="=" Zn2(OH)2CO3 ↓+2(NH4)2 SO4 + H2O (2分)
(1)< (2分)
(2)B C (2分)
(3)3.2~6.2 (2分)
(4)Fe3++3NH3·H2O ="==" Fe(OH)3↓+3 NH4+ (2分)
(5)2.7×10-21 (2分)
(6)(NH4)2SO4 (2分)
(7)2ZnSO4 +NH4HCO3 +3 NH3·H2O="=" Zn2(OH)2CO3 ↓+2(NH4)2 SO4 + H2O (2分)
(1)在H2SO4的作用下ZnS可以溶解而CuS不溶,显然Ksp(CuS)<Ksp(ZnS);
(2)除杂的同时不能引入新的杂技,所以A、D不可选,在H2O2和O2的作用下,Fe2+被氧化为Fe3+离子。
(3)根据298K时各离子开始沉淀及完全沉淀时的pH分析可知,要将Fe3+离子充分沉淀完全,而不能使Zn2+沉淀,pH应控制在3.2~6.2 范围之间;
(4)NH3·H2O是弱碱,在书写离子方程式时不能拆成离子的形式:
(5)Zn2+沉淀的pH应控制在8.0以上,所以,残留在乙溶液中的c(Fe3+)≤2.7×10-21
(6)乙的溶液可直接用作氮肥主要是含有(NH4)2SO4;
(7)2ZnSO4 +NH4HCO3 +3 NH3·H2O="=" Zn2(OH)2CO3 ↓+2(NH4)2 SO4 + H2O
(2)除杂的同时不能引入新的杂技,所以A、D不可选,在H2O2和O2的作用下,Fe2+被氧化为Fe3+离子。
(3)根据298K时各离子开始沉淀及完全沉淀时的pH分析可知,要将Fe3+离子充分沉淀完全,而不能使Zn2+沉淀,pH应控制在3.2~6.2 范围之间;
(4)NH3·H2O是弱碱,在书写离子方程式时不能拆成离子的形式:
(5)Zn2+沉淀的pH应控制在8.0以上,所以,残留在乙溶液中的c(Fe3+)≤2.7×10-21
(6)乙的溶液可直接用作氮肥主要是含有(NH4)2SO4;
(7)2ZnSO4 +NH4HCO3 +3 NH3·H2O="=" Zn2(OH)2CO3 ↓+2(NH4)2 SO4 + H2O

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
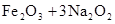

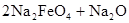 ,下列说法正确的是
,下列说法正确的是