题目内容
【题目】实验室欲用NaOH固体配制0.5mol/L的NaOH溶液225mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却⑨摇动,其正确的操作顺序为 . 本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、 .
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,则烧杯的实际质量为g,要完成本实验该同学应称出g NaOH. 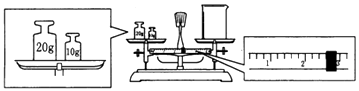
(3)使用容量瓶前必须进行的一步操作是 .
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是 . (填写序号)
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③定容时俯视刻度线
④容量瓶不干燥,含有少量蒸馏水
⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
【答案】
(1)②①③⑧⑤⑥⑨⑦④;250 mL容量瓶、胶头滴管
(2)27.4;5.0
(3)检漏
(4)③
【解析】解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签,所以正确的步骤为:②①③⑧⑤⑥⑨⑦④;用到的仪器:托盘天平、钥匙、烧杯、玻璃棒、容量瓶、胶头滴管,配制225mL溶液应选择250mL容量瓶,所以还缺少的仪器:250 mL容量瓶、胶头滴管;所以答案是:②①③⑧⑤⑥⑨⑦④;250 mL容量瓶、胶头滴管;(2)先看图中称量方式是左码右物,所称物品质量为砝码﹣游码,再据图读数,砝码20、10共30g,游码2.6g,所以烧杯质量为10+20﹣2.6=27.4g;配制0.5mol/L的NaOH溶液225mL,应选择250mL容量瓶,秤取溶质的质量为:0.5mol/L×0.25L×40g/mol=5.0g;
所以答案是:27.4;5.0;(3)容量瓶带有活塞,使用过程中需要上下颠倒,为防止漏水,使用前应检查是否漏水;
所以答案是:检漏;(4)①没有洗涤烧杯和玻璃棒,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;②转移溶液时不慎有少量洒到容量瓶外面,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;③定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选;④容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故不选;⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
故选:③.
【考点精析】通过灵活运用配制一定物质的量浓度的溶液,掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线即可以解答此题.

 阅读快车系列答案
阅读快车系列答案