题目内容
(14分)2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
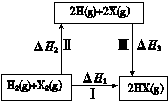
⑴火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H="-" 534 kJ·mol-1 ①
H2O2(1)=H2O(1)+1/2O2(g) △H="-" 98.64 kJ·mol-1 ②
H2O(1)=H2O(g) △H=+44kJ·mol-l ③
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H= ,
⑵据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作 原料的燃 料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电,其工作原理如图所示。
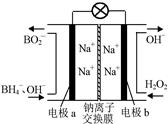
则该电池的正极反应____ ___
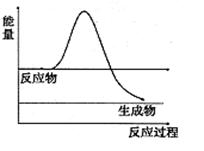
⑶H2O2是一种不稳定易分解的物质。右图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图 。
⑷某化学兴趣小组欲测定H2O2的分解速率,取溶液0.5L进行分析,数据如表格所示:
在上述表格中已知某一时刻向H2O2溶液中加入催化剂,则加入催化剂后整段时间内H2O2的平均分解速率___________。
⑸H2O2还是一种药物化学分析的氧化剂,能用于药物的分析。

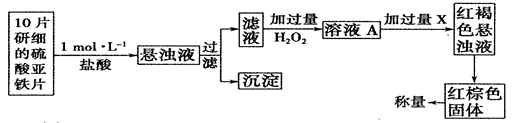
①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为
_________(小数点后面保留一位有效数字)。
⑴火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H="-" 534 kJ·mol-1 ①
H2O2(1)=H2O(1)+1/2O2(g) △H="-" 98.64 kJ·mol-1 ②
H2O(1)=H2O(g) △H=+44kJ·mol-l ③
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H= ,
⑵据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作 原料的燃 料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电,其工作原理如图所示。

则该电池的正极反应____ ___
⑶H2O2是一种不稳定易分解的物质。右图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图 。

⑷某化学兴趣小组欲测定H2O2的分解速率,取溶液0.5L进行分析,数据如表格所示:
| t(S) | 0 | 2 | 4 | 6 | 8 | 10 |
| n(H2O2) (moL) | 0.8 | 0.7 | 0.62 | 0.55 | 0.27 | 0.03 |
⑸H2O2还是一种药物化学分析的氧化剂,能用于药物的分析。


①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为
_________(小数点后面保留一位有效数字)。
(14分,每空2分) -643.28KJ/mol H2O2+2e-=2OH- 略 0.26 mol/( L.S)
H2O2+2Fe2++2H+=2Fe3++2H2O A.B.F.E 56.7%
H2O2+2Fe2++2H+=2Fe3++2H2O A.B.F.E 56.7%
试题分析:(1)根据盖斯定律得所求△H="①+②×2+③×2=-" 534 kJ·mol-1+(- 98.64 kJ·mol-1 )×2+-44 kJ·mol-1 ×2=-643.28KJ/mol ;
(2)正极发生还原反应,所以从图中可知,正极是过氧化氢的还原反应生成氢氧根离子,电极反应式为H2O2+2e-=2OH-
(3)使用催化剂,可以降低反应的活化能,加快反应速率,但反应热不变,所以在原图的基础上降低曲线的高度,但起点与终点不变;
(4)从表中数据可知,前6s内过氧化氢的物质的量减少缓慢,6s后,过氧化氢的物质的量减少很快,说明此时加入了催化剂,所以6s~10s之间,过氧化氢的浓度减少(0.55mol-0.03mol)/0.5L,则这段时间的平均反应速率为(0.55mol-0.03mol)/0.5L/4s="0.26" mol/( L·S);
(5)①过氧化氢与硫酸亚铁发生氧化还原反应生成硫酸铁和水,离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O
②红棕色固体是氧化铁固体,所以从红褐色浊液到红棕色固体需要过滤沉淀,洗涤沉淀,灼烧沉淀为氧化铁,冷却,最后称量,所以答案选ABFE;
③0.8960g的氧化铁的物质的量是0.0056mol,则药片中硫酸亚铁的质量为0.0056mol×2×152g/mol=1.7024g,10片药片的质量是0.3g×10=3g,所以药片中硫酸亚铁的质量分数为1.7024g/3g×100%=56.7%

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目




 N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
 2CO2(g)+2H2O(l) ΔH1="-870.3" kJ·mol-1
2CO2(g)+2H2O(l) ΔH1="-870.3" kJ·mol-1