题目内容
16.某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验: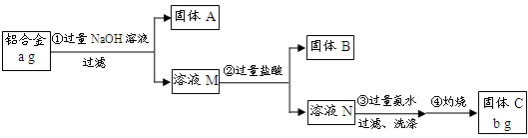
已知:(1)该铝合金的主要成分为铝、镁、铜、硅.
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O═Na2SiO3+2H2↑.
(3)硅酸不溶于水
(4)固体C为Al2O3
请回答下列问题:
(1)固体A在潮湿的空气中久置可能会发生一个明显的变化,这个变化是表面生成绿色的铜锈;发生反应的化学方程式为2Cu+O2+H2O+CO2=Cu2(OH)2CO3;
(2)步骤③中洗涤沉淀的实验操作为将沉淀置于过滤器中,加蒸馏水刚好浸没沉淀,待水自然流下,重复2到3次;
(3)该样品中铝的质量分数是$\frac{9b}{17a}$×100%(用a、b表示);
(4)下列因操作不当,会使测定结果偏大的是AC;
A.第③步中沉淀未用蒸馏水洗涤 B.第①步中加入NaOH溶液不足
C.第④步对沉淀灼烧不充分.
分析 铝合金的主要成分为铝、镁、铜、硅加入过量氢氧化钠溶液过滤,固体A为Mg、Cu,溶液M为NaAlO2,Na2SiO3,溶液M中加入过量盐酸反应过滤得到固体B为H2SiO3,溶液N中为AlCl3溶液加入过量氨水过滤洗涤得到氢氧化铝沉淀灼烧得到固体C为Al2O3;
(1)固体A在潮湿的空气中久置可能会生成铜绿,即碳式碳酸铜,根据元素守恒书写化学方程式;
(2)沉淀的洗涤操作同过滤操作,即将沉淀置于过滤器中,加蒸馏水刚好浸没沉淀,待水自然流下,重复2到3次;
(3)分析可知固体C为Al2O3,依据铝元素守恒计算;
(4)A.第③步中沉淀未用蒸馏水洗涤,表面有杂质氯化钠、氯化铵,灼烧氯化铵分解,氯化钠对测定结果固体C质量增大;
B.第①步中加入NaOH溶液不足,铝为全部溶解,测定结果偏低;
C.第④步对沉淀灼烧不充分,得到固体C质量增大.
解答 解:铝合金的主要成分为铝、镁、铜、硅加入过量氢氧化钠溶液过滤,固体A为Mg、Cu,溶液M为NaAlO2,Na2SiO3,溶液M中加入过量盐酸反应过滤得到固体B为H2SiO3,溶液N中为AlCl3溶液加入过量氨水过滤洗涤得到氢氧化铝沉淀灼烧得到固体C为Al2O3;
(1)固体A在潮湿的空气中久置可能会表面生成绿色的铜锈,即碳式碳酸铜,反应的化学方程式为2Cu+O2+H2O+CO2=Cu2(OH)2CO3,
故答案为:表面生成绿色的铜锈;2Cu+O2+H2O+CO2=Cu2(OH)2CO3;
(2)沉淀的洗涤操作同过滤操作,即将沉淀置于过滤器中,加蒸馏水刚好浸没沉淀,待水自然流下,重复2到3次;
故答案为:将沉淀置于过滤器中,加蒸馏水刚好浸没沉淀,待水自然流下,重复2到3次;
(3)分析可知bg固体C为Al2O3,依据铝元素守恒计算,铝的质量分数=$\frac{\frac{bg}{102g/mol}×2×27g/mol}{ag}$×100%=$\frac{9b}{17a}$×100%;
故答案为:$\frac{9b}{17a}$×100%;
(4)A.第③步中沉淀未用蒸馏水洗涤,表面有杂质氯化钠、氯化铵,灼烧氯化铵分解,氯化钠对测定结果固体C质量增大,铝质量分数增大,故A正确;
B.第①步中加入NaOH溶液不足,铝为全部溶解,测定结果偏低,故B不符合;
C.第④步对沉淀灼烧不充分,得到固体C质量增大,铝质量分数增大,故C正确;
故答案为:AC.
点评 本题考查了物质组成的实验测定过程分析判断,物质性质的理解应用,实验基本操作的熟练掌握是解题关键,题目难度中等.

 互动英语系列答案
互动英语系列答案| 实验操作 | 结论 | |
| A | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失 | 一定含有SO42- |
| B | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中溶液变浑浊 | 可能含有HCO3- |
| C | 加入NaOH溶液有白色沉淀生成 | 一定含有Al3+ |
| D | 用四氯化碳萃取某溶液时,分层且下层显紫红色 | 一定含有碘单质 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入试管口中 | |
| B. | 硫酸必须用棕色试剂瓶保存 | |
| C. | 浓烧碱液沾到皮肤上应立即用大量水冲洗,然后涂上稀硼酸溶液 | |
| D. | 蒸馏时,应将温度计的水银球插入液面以下 |
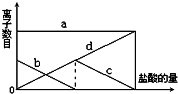 往含有少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化,四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )
往含有少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化,四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )| A. | a:Cl-b:K+ c:CO32- d:HCO3- | |
| B. | a:K+ b:CO32- c:Cl- d:HCO3- | |
| C. | a:K+ b:CO32- c:HCO3- d:Cl- | |
| D. | a:K+ b:HCO3- c:Cl- d:CO32- |
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
(2)下列能说明该反应达到平衡状态的是BD.
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
(3)该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热反应(填“吸热”或“放热”).
(4)该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是BC.
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2
(5)100℃时,若将9.2gNO2和N2O4气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)<v逆(N2O4).(填“>”、“=”或“<”)
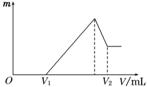 将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答: