题目内容
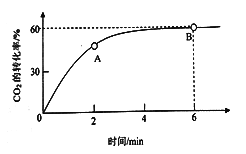
【题目】现有短周期主族元素X、Y、Z、R、T五种,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是

A. 离子半径:Y<Z
B. 氢化物的稳定性:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z三种元素组成的常见化合物中含有离子键
【答案】D
【解析】短周期主族元素中,R原子最外层电子数是电子层数的2倍,可能为C或S,由图中原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;Y与T同主族,则T应为S,X的原子半径最小,原子序数最小,则X为H元素;A.离子电子层结构相同,核电荷数越大离子半径越小,则离子半径O2->Na+,故A错误;B.非金属性O>S,故氢化物稳定性:H2O>H2S,故B错误;C.非金属性S>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C错误;D.由H、O、Na三种元素组成的化合物为NaOH,含有离子键,故D正确;故答案为D。

练习册系列答案
相关题目
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
B | 向某黄色溶液中加入淀粉KI溶液 | 溶液呈蓝色 | 溶液中含Br2 |
C | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
D | 向久置的Na2SO3溶液中加入足量BaCl2溶液,再加入足最稀盐酸 | 先出现白色沉淀,后部分沉淀溶解 | 部分Na2SO3被氧化 |
A. A B. B C. C D. D