题目内容
18.某兴趣小组模拟企业对含铬废水(Cr2O72-和Cr3+)处理流程如图1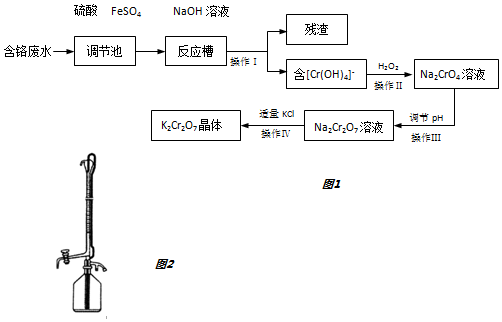
已知:2CrO42-+2H+═Cr2O72-+H2O
请回答:
(1)用离子方程式表示调节池里发生的反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O.
(2)操作Ⅰ得到的残渣的化学式为Fe(OH)3.
(3)操作Ⅲ调节pH时最适合作为调节剂的是B.
A.4mol•L-1盐酸 B.6mol•L-1硫酸C.石灰乳 D.碳酸钠
(4)为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,用浓醋酸调节pH=5,并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr3+,再用amol•L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
①滴定时采用如图2所示的侧边自动定零位滴定管,具有的优点是操作简单,无视力误差,计算精确.
②实验消耗EDTA标准溶液b mL,则处理后废液中含铬浓度为520abmg•L-1(用含a、b的式子表示).
分析 含铬废水(Cr2O72-和Cr3+)加入硫酸和硫酸亚铁,进入调节池发生氧化还原反应收藏铁离子和铬离子,加入氢氧化钠溶液过滤得到滤渣为氢氧化铁沉淀,滤液含Cr(OH)4-,加入过氧化氢酸性溶液中氧化Cr(OH)4-,生成Na2CrO4,操作Ⅲ小调节溶液PH,2CrO42-+2H+═Cr2O72-+H2O,酸溶液应选择硫酸,盐酸易被氧化所以不选择盐酸,得到的Na2Cr2O7溶液,加入适量KCl过滤得到K2Cr2O7晶体,
(1)调节池里发生的反应是酸性溶液中重铬酸跟离子氧化亚铁离子生成铁离子;
(2)操作Ⅰ得到的残渣为氢氧化铁;
(3)操作Ⅲ调节pH时最适合作为调节剂的是非还原性的酸;
(4)①自动定零位滴定管使得测定结果更准确,操作简单;
②Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
反应定量关系为:Cr2O72-→2Cr3+~2H4Y(EDTA)
n(Cr3+)=n(EDTA)=amol•L-1×b×10-3L=ab×10-3mol,计算得到铬离子的浓度.
解答 解:含铬废水(Cr2O72-和Cr3+)加入硫酸和硫酸亚铁,进入调节池发生氧化还原反应收藏铁离子和铬离子,加入氢氧化钠溶液过滤得到滤渣为氢氧化铁沉淀,滤液含Cr(OH)4-,加入过氧化氢酸性溶液中氧化Cr(OH)4-,生成Na2CrO4,操作Ⅲ小调节溶液PH,2CrO42-+2H+═Cr2O72-+H2O,酸溶液应选择硫酸,盐酸易被氧化所以不选择盐酸,得到的Na2Cr2O7溶液,加入适量KCl过滤得到K2Cr2O7晶体,
(1)调节池里发生的反应是酸性溶液中重铬酸跟离子氧化亚铁离子生成铁离子的反应,反应的离子方程式为:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O;
(2)分析可知,操作Ⅰ得到的残渣为氢氧化铁,化学式为:Fe(OH)3,故答案为:Fe(OH)3;
(3)操作Ⅲ调节pH时最适合作为调节剂的是非还原性的酸,
A.4mol•L-1盐酸也会被重铬酸根离子氧化生成氯气,故A错误;
B.6mol•L-1硫酸溶液可以调节溶液PH,起到酸化作用,故B正确;
C.石灰乳为氢氧化钙浊液,不能调节溶液PH得到Cr2O72-离子,故C错误;
D.碳酸钠溶液显碱性,2CrO42-+2H+═Cr2O72-+H2O,平衡逆向进行不能得到Cr2O72-离子,故D错误;
故答案为:B;
(4)①自动定零位滴定管使得测定结果更准确,操作简单,滴定时采用如图2所示的侧边自动定零位滴定管,具有的优点是:操作简单,无视力误差,计算精确,
故答案为:操作简单,无视力误差,计算精确;
②Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
反应定量关系为:Cr2O72-→2Cr3+~2H4Y(EDTA)
n(Cr3+)=n(EDTA)=amol•L-1×b×10-3L=ab×10-3mol,
计算得到铬离子的浓度=$\frac{ab×1{0}^{-3}mol×52g/mol}{0.1L}$=0.52abg/L=520ab mg/L.
故答案为:520ab mg/L;
点评 本题考查了物质分离提纯的方法和实验基本操作、滴定实验的分析和计算,主要是物质性质和化学平衡的理解应用,掌握基础是解题关键,题目难度中等.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案| A. | 用Cu作阳极电解饱和食盐水:Cu+2H+$\frac{\underline{\;电解\;}}{\;}$Cu2++H2↑ | |
| B. | Fe3O4溶于氢碘酸溶液中:Fe3O4+8H++2I-=3Fe2++I2+4H2O | |
| C. | NH4Al(SO4)2溶于过量的浓Ba(OH)2溶液中:NH4++A13++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+NH3↑+H2O | |
| D. | 澄清石灰水中充入过量的SO2:SO2+OH-=HSO3- |
| A. | 原子半径大小:Z>Y>X>W | |
| B. | 由W元素形成的单质一定是原子晶体,其熔沸点很高 | |
| C. | W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 | |
| D. | Y、Z所形成的氧化物的水化物的酸性为:Y<Z |
| A. |  | B. |  | C. |  | D. |  |
 如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )| A. | a极为负极,发生还原反应 | |
| B. | b电极上电极反应:O2+2H2O+4e-=4OH- | |
| C. | 工作时电子由b极经外电路流向a极 | |
| D. | 该装置实现了电能转化成化学能 |
| A. | 2.8g铁粉与50mL 4mol•L-1盐酸反应,转移电子的数目为0.15NA | |
| B. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| C. | 常温常压下,16g O2和O3混合气体中含有的氧原子数为NA | |
| D. | 1mol•L-1 AlCl3溶液中含有的Cl-数目为3NA |
| A. | O4的摩尔质量是64g | |
| B. | O4与O3、O2互为同位素 | |
| C. | 相同质量的O4与O3所含原子个数之比为1:1 | |
| D. | 32gO4所含的电子数为32NA(NA为阿伏加德罗常数) |
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题: