题目内容
8.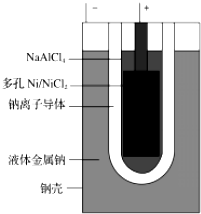 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:(1)钠、钾着火,下列可用来灭火的是C.
A.水 B.干冰 C.细沙 D.泡沫灭火器
(2)白磷有毒能和氯酸(HClO3溶液发生反应生成一种常见的强酸和一种三元酸,氧化剂是HClO3或氯酸,氧化产物是H3PO4或磷酸,1mol P4参加反应转移20mol电子.
(3)钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题.
①钠比锂活泼,用原子结构解释原因最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强.
②钠电池“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间
由钠离子导体制作的陶瓷管相隔.写出该电池的正极反应:NiCl2+2e-=Ni+2Cl-.
分析 (1)钠、钾着火生成过氧化钠,可与二氧化碳或水反应生成氧气,且钠、钾与水反应生成氢气;
(2)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0);
(3)①同一主族元素的原子,原子半径越大,金属活泼性越强;
②原电池的正极上发生得电子的还原反应.
解答 解:(1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧,所以应该采用细沙灭火,
故答案为:C;
(2)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,所以HClO3是氧化剂、H3PO4是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0)=20mol;
故答案为:HClO3或氯酸;H3PO4或磷酸; 20;
(3)①同一主族元素的原子Na、Li,原子半径越大,金属活泼性越强,即钠比锂活泼,
故答案为:最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强;
②ZEBRA电池的正极上发生得电子的还原反应,即NiCl2+2e-=Ni+2Cl-,
故答案为:NiCl2+2e-=Ni+2Cl-.
点评 本题为综合题,涉及钠、钾性质,氧化还原反应基本概念及计算,原电池电极反应书写,熟悉相关物质的性质,明确原电池正、负极发生反应是解题关键,题目难度中等.

练习册系列答案
相关题目
13.用惰性电极电解50mL CuSO4溶液,当两极均生成112mL气体(标准状况下)下列判断不正确的是( )
| A. | 原CuSO4溶液的浓度为0.1mol/L | |
| B. | 反应过程中共转移0.02mol电子 | |
| C. | 向电解后的溶液中加入适量CuO,可恢复到原溶液 | |
| D. | 阳极周围溶液的pH减小 |
13.下列鉴别方法可行的是( )
①用NaOH溶液鉴别Al3+、Mg2+、Cu2+
②用Ba(NO3)2溶液鉴别Cl-、SO42-、和CO32-
③用KMnO4酸性溶液鉴别HCHO、CH2=CH2和CO2
④用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷.
①用NaOH溶液鉴别Al3+、Mg2+、Cu2+
②用Ba(NO3)2溶液鉴别Cl-、SO42-、和CO32-
③用KMnO4酸性溶液鉴别HCHO、CH2=CH2和CO2
④用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ②④ |
20.已知草酸为二元中强酸,具有较强还原性,草酸氢钠(NaHC2O4)水溶液呈酸性,下列说法正确的是( )
| A. | 草酸与氢氧化钠溶液混合呈中性时,溶液中存在:c(Na+)=c(HC2O4-)+c(C2O42-) | |
| B. | NaHC2O4与NaClO溶液混合,反应的离子方程式为:HC2O4-+ClO-=HClO+C2O42- | |
| C. | 草酸铵溶液中:c(NH4+)=2 c(H2C2O4)+2 c(HC2O4-)+2 c(C2O42-) | |
| D. | 草酸使酸性KMnO4溶液褪色,其离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O | |
| C. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
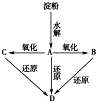 如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之
如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之 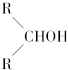 最难.
最难.