题目内容
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:
下列判断错误的是
| A.气体甲可能是混合物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
| C.白色沉淀乙的主要成分是氢氧化铝 |
| D.K+、[Al(OH)4]-和SiO32-一定存在于溶液X中 |
B
解析试题分析:加盐酸有气体甲生成,这说明溶液中含有CO32-离子或SO32-、,生成的气体是二氧化碳或SO2,即甲是CO2或SO2。因此一定不存在和碳酸根或SO32-不共存的离子,所以不存在镁离子、铝离子。加足量盐酸有沉淀,说明一定有硅酸根离子,硅酸是沉淀,即沉淀甲是硅酸。无色溶液甲中加入过量氨水(提供OH-)有沉淀生成,只能是氢氧化铝沉淀,说明此时溶液中存在铝离子,但是原来溶液中的铝离子一定不能存在,所以该铝离子是[Al(OH)4]-和盐酸反应生成的,所以,一定存在[Al(OH)4]-。根据溶液显电中性可知,要保证溶液电中性,只有K+这一个阳离子,所以一定存在钾离子,而SO42-不能确定。A、气体甲可能是CO2和SO2的混合气,故A正确;B、溶液中一定不含有镁离子,所以沉淀甲是硅酸,不可能是硅酸镁,故B不正确;C、白色沉淀乙是氢氧化铝,故C正确;D、根据以上分析可知K+、[Al(OH)4]-和SiO2- 3一定存在于溶液X中,故D正确,答案选B。
考点:考查离子共存和离子检验的判断

下列反应中属于氧化还原反应的离子方程式的是
| A.CaCO3+2H+=Ca2++CO2↑+H2O | B.2Fe2++Cl2=2Fe3++2Cl- |
| C.HCO3-+H+=CO2+H2O | D.Na2O+H2O=2Na++2OH- |
下列物质属于非电解质,但水溶液能够导电的是
| A.蔗糖 | B.NaOH | C.CaO | D.NH3 |
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,出现灯泡由亮变暗,至熄灭后又逐渐变亮现象的是
| A.氢氧化钡溶液中逐滴加入硫酸 |
| B.氢氧化钠溶液中逐滴加入硫酸 |
| C.石灰乳中逐滴加入稀盐酸 |
| D.食盐溶液中逐滴加入盐酸 |
在由水电离出的c(H+)=10-13mol·L-1的溶液中一定能够大量存在的离子组是
| A.Ba2+、Na+、Cl-、NO3- | B.Al3+、Ca2+、SO42-、Br- |
| C.NH4+、K+、HSO3-、CO32- | D.Na+、K+、Cl-、I- |
下列离子方程式不正确的是
| A.将一小粒金属钠放入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B.将氯气通入氢氧化钠溶液中:Cl2+2OH-=C1-+C1O-+H2O |
| C.向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
| D.向稀硝酸中加人铜片:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
下列离子组在强酸性溶液中能大量共存、且溶液为无色透明的是
| A.NH4+、Al3+、SO42-、NO3- | B.Ag+、Na+、[Al(OH)4]-、Cl- |
| C.K+、NH4+、MnO4-、SO42- | D.K+、Na+、SO42-、HCO3- |
如图表示在某溶液中滴加Ba(OH)2溶液时,生成的沉淀的物质的量随Ba(OH)2溶液的体积变化关系。该溶液的成分可能是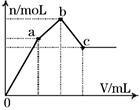
| A.NH4Al(SO4)2 | B.KAl(SO4)2 |
| C.Al2(SO4)3 | D.Na2SO4与NaAlO2组成的混合物 |
向100ml的下列各溶液中加入少量的NaOH固体,溶液导电性变化最不明显的是
| A.盐酸 | B.醋酸 | C.蒸馏水 | D.氨水 |