题目内容
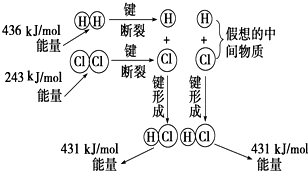 如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )
如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )| A、1 molH2中的化学键断裂时需要吸收436 kJ能量 | ||||
| B、2 molHCl分子中的化学键形成时要释放862 kJ能量 | ||||
| C、此反应的热化学方程式为:H2(g)+Cl2(g)═2HCl(g)△H=+183 kJ/mol | ||||
D、此反应的热化学方程式为:
|
分析:A、依据反应焓变=反应物键能总和-生成物键能总和得反应焓变,标注物质聚集状态和对应反应的焓变写出热化学方程式分析判断;
B、形成氯化氢分子是形成化学键过程释放能量,依据1mol氯化氢化学键形成放热431KJ计算判断;
C、氢气断裂化学键吸收能量;
D、焓变=反应物键能总和-生成物键能总和觉得反应焓变,标注物质聚集状态和对应反应的焓变写出热化学方程式.
B、形成氯化氢分子是形成化学键过程释放能量,依据1mol氯化氢化学键形成放热431KJ计算判断;
C、氢气断裂化学键吸收能量;
D、焓变=反应物键能总和-生成物键能总和觉得反应焓变,标注物质聚集状态和对应反应的焓变写出热化学方程式.
解答:解:A、氢气断裂化学键吸收能量,1molH2中的化学键断裂时需要吸收436kJ能量,故A正确;
B、形成氯化氢分子是形成化学键过程释放能量,依据1mol氯化氢化学键形成放热431kJ,2molHCl分子中的化学键形成时要释放862kJ能量,故B正确;
C、反应H2(g)+Cl2(g)═2HCl(g),焓变△H=反应物键能总和-生成物键能总和=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,反应是放热反应,故C错误;
D、反应H2(g)+Cl2(g)═2HCl(g),焓变△H=反应物键能总和-生成物键能总和=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,热化学方程式为:
H2(g)+
Cl2(g)═HCl(g)△H=-91.5kJ?mol-1,故D正确;
故选C.
B、形成氯化氢分子是形成化学键过程释放能量,依据1mol氯化氢化学键形成放热431kJ,2molHCl分子中的化学键形成时要释放862kJ能量,故B正确;
C、反应H2(g)+Cl2(g)═2HCl(g),焓变△H=反应物键能总和-生成物键能总和=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,反应是放热反应,故C错误;
D、反应H2(g)+Cl2(g)═2HCl(g),焓变△H=反应物键能总和-生成物键能总和=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,热化学方程式为:
| 1 |
| 2 |
| 1 |
| 2 |
故选C.
点评:本题考查了反应过程中能量变化,焓变和键能的关系计算应用,热化学方程式书写方法,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
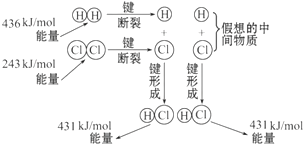 如图所示是101kPa时,氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )
如图所示是101kPa时,氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )| A、此反应的热化学方程式为:H2(g)+Cl2(g)═2HCl(g)△H=+183kJ?mol-1 | B、2molHCl分子中的化学键形成时要释放862kJ能量 | C、1molH2中的化学键断裂时需要吸收436kJ能量 | D、此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g)═HCl(g)△H=-91.5kJ?mol-1 |