题目内容
如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )
A.1 mol H2中的化学键断裂时需要吸收436 kJ能量
B.2 mol HCl分子中的化学键形成时要释放862 kJ能量
C.此反应的热化学方程式为:H2(g)+Cl2(g)===2HCl(g) ΔH=+183 kJ/mol
D.此反应的热化学方程式为:H2(g)+Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol
C
解析:考查从微观的角度来理解反应热。在化学反应过程中,断键需要吸热,形成新键需要放热。由图可知,断裂1molH-H键和1molCl-Cl需要吸热分别为436kJ、243kJ,而形成1molH-Cl时放热431kJ,所以该反应的反应热是436+243-2×431=-183kJ/mol,即反应是放热反应,所以答案是C。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
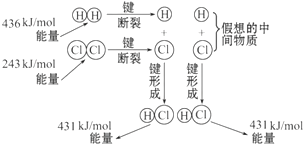 如图所示是101kPa时,氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )
如图所示是101kPa时,氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )| A、此反应的热化学方程式为:H2(g)+Cl2(g)═2HCl(g)△H=+183kJ?mol-1 | B、2molHCl分子中的化学键形成时要释放862kJ能量 | C、1molH2中的化学键断裂时需要吸收436kJ能量 | D、此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g)═HCl(g)△H=-91.5kJ?mol-1 |
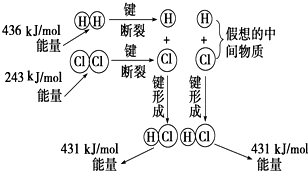 如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )
如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )| A、1 molH2中的化学键断裂时需要吸收436 kJ能量 | ||||
| B、2 molHCl分子中的化学键形成时要释放862 kJ能量 | ||||
| C、此反应的热化学方程式为:H2(g)+Cl2(g)═2HCl(g)△H=+183 kJ/mol | ||||
D、此反应的热化学方程式为:
|