��Ŀ����
����Ŀ���������ֿ���������A��B��C��D��E���������������������ӻ�����ͬ���ֱ�������������K+��Fe3+��Cu2+��Ba2+��Al3+��������������Cl����OH����NO![]() ��CO
��CO![]() ��X�е�һ�֡�
��X�е�һ�֡�
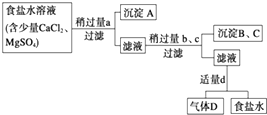
��1��ijͬѧͨ���ȽϷ�����֪���������������ʵ�ˮ��Һ�ʼ��ԣ��ɴ˿��ж�������������__________��___________��
��2������C�к�������X��Ϊ��ȷ��X���ֽ���1���е��������ʼ�ΪA��B���� C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壬��XΪ________������ţ���
A��Br�� B��CH3COO�� C��SO42�� D��HCO3��
��3����19.2gCuͶ��װ������D��Һ���Թ��У�Cu���ܽ⣬�ٵμ�ϡH2SO4��Cu���ܽ⣬�ܿڸ����к���ɫ������֣�д��Cu�ܽ�����ӷ���ʽ___________________________________����Ҫ��Cu��ȫ�ܽ⣬���ټ���H2SO4�����ʵ�����___________________________��
��4��E��Һ������ᷴӦʱ��������ɫ���ʣ��÷�Ӧ�����ӷ���ʽΪ��________________________��
���𰸡� K2CO3 Ba(OH)2 C 3Cu��8H+��2NO3����3Cu2+��2NO����4H2O 0.4 mol 2Fe3+��2I����2 Fe2+��I2
��������(1) ��OH������Fe3+��Cu2+��Al3+���棬CO![]() ����Fe3+��Cu2+��Ba2+��Al3+���棬����Ϊ���������ʵ�ˮ��Һ�ʼ��ԣ���������������ܺ������������ӻ�����ǿ����ˮ����ã��ۺϷ����ó����ּ���������K2CO3 �� Ba(OH)2
����Fe3+��Cu2+��Ba2+��Al3+���棬����Ϊ���������ʵ�ˮ��Һ�ʼ��ԣ���������������ܺ������������ӻ�����ǿ����ˮ����ã��ۺϷ����ó����ּ���������K2CO3 �� Ba(OH)2
��2����C��A����Һ���ʱ������ɫ���������C�к���ͭ���ӣ���ɫ������������ͭ����ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壬��˸ð�ɫ���������ᱵ������C������ͭ����A������������B��̼��ء�X��SO42-����ѡC��
��3����19.2g CuͶ��װ������D��Һ���Թ��У�Cu���ܽ⣬��˵��D�в����������ӡ��ٵμ�ϡH2SO4��Cu���ܽ⣬�ܿڸ����к���ɫ������֣���������NO2����˵��D�к���NO3�������D����������������������NO3������ǿ�����ԣ��ܺͽ���ͭ��Ӧ����������ͭ��NO��ˮ��NO���������ɺ���ɫNO2����Cu�ܽ�����ӷ���ʽΪ3Cu��8H����2NO3--��3Cu2����2NO����4H2O��19.2gͭ�����ʵ�����19.2g��64g/mol��0.3mol�����ݷ���ʽ��֪�����������ӵ����ʵ�����0.8mol������������Ҫ��������ʵ�����0.4mol��
��4���������Ϸ�����֪��E���Ȼ�����������ᷴӦʱ��������ɫ����Ϊ�ⵥ�����������������˵����ӣ���Ӧ�����ӷ���ʽΪ2Fe3+��2I����2 Fe2+��I2 ��

 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�