题目内容
甲醇是一种化工原料,工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ?mol-1.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
①容器内压强P:2P甲与2P乙与P丙关系是
②变化的热量数值Q中,Q1 与Q2的和是
③画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,要求画出压强不同的两条曲线(标出p1、p2,且p1<p2).
④在一定温度和压强下,CO和H2催化合成二甲醚反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)如图 为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO.2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
2P甲等于2P乙且大于P丙
2P甲等于2P乙且大于P丙
②变化的热量数值Q中,Q1 与Q2的和是
90.8
90.8
③画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,要求画出压强不同的两条曲线(标出p1、p2,且p1<p2).
④在一定温度和压强下,CO和H2催化合成二甲醚反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)如图
 为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为CH3OCH3-12e-+3H2O=2CO2+12H+
CH3OCH3-12e-+3H2O=2CO2+12H+
.分析:甲容器反应物投入1molCO.2molH2与乙容器反应物投入1mol CH3OH在保持恒温、恒容情况下是等效平衡,平衡时CH3OH的浓度c1=c2 、α1+α2=1、Q1+Q2能量总变化相当于1molCO.2molH2完全转化成1mol CH3OH的能量,即吸放热Q1+Q2数值上就等于90.8kJ;甲容器反应物投入量1molCO、2molH2与丙容器反应物投入量2molCO、4molH2,若恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡,然而现在是温度、容积相同的3个密闭容器,可以当成是在恒温且容积是甲容器两倍条件下,体积受到了压缩,原反应正向气体体积减少,由平衡移动原理,则相较于甲容器(或假设状况)而言,丙容器平衡向正向移动,也就是说,丙容器的转化率比甲容器还要大一些.因此2c1<c3、α2<α3,反应在相同温度下进行,平衡常数相等,该燃料电池的正极反应为:02+4e-+4H+═2H2O,负极反应为:CH3OCH3-12e-+3H2O=2CO2+12H+,以此解答该题.
解答:解:①甲容器反应物投入1molCO.2molH2与乙容器反应物投入1mol CH3OH在保持恒温、恒容情况下是等效平衡,则达到平衡时甲、乙容器压强相等,甲容器反应物投入量1molCO、2molH2与丙容器反应物投入量2molCO、4molH2,丙可以当成是在恒温且容积是甲容器两倍条件下,体积受到了压缩,原反应正向气体体积减少,则有2P甲等于2P乙且大于P丙,
故答案为:2P甲等于2P乙且大于P丙;
②甲容器反应物投入1molCO.2molH2与乙容器反应物投入1mol CH3OH在保持恒温、恒容情况下是等效平衡,反应分别由正方向和逆方向进行,则Q1与Q2和是90.8,能量总变化相当于1molCO.2molH2完全转化成1mol CH3OH的能量,
故答案为:90.8;
③正反应放热,则升高温度、平衡向逆方向移动,甲醇的含量降低,根据方程式可知增大压强,平衡向正方向移动,甲醇的含量增大,则图象可为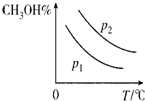 ,
,
故答案为: ;
;
④a极通入二甲醚,应为原电池的负极,发生氧化反应,电极方程式为CH3OCH3-12e-+3H2O=2CO2+12H+,
故答案为:CH3OCH3-12e-+3H2O=2CO2+12H+.
故答案为:2P甲等于2P乙且大于P丙;
②甲容器反应物投入1molCO.2molH2与乙容器反应物投入1mol CH3OH在保持恒温、恒容情况下是等效平衡,反应分别由正方向和逆方向进行,则Q1与Q2和是90.8,能量总变化相当于1molCO.2molH2完全转化成1mol CH3OH的能量,
故答案为:90.8;
③正反应放热,则升高温度、平衡向逆方向移动,甲醇的含量降低,根据方程式可知增大压强,平衡向正方向移动,甲醇的含量增大,则图象可为
 ,
,故答案为:
 ;
;④a极通入二甲醚,应为原电池的负极,发生氧化反应,电极方程式为CH3OCH3-12e-+3H2O=2CO2+12H+,
故答案为:CH3OCH3-12e-+3H2O=2CO2+12H+.
点评:本题综合考查化学平衡、电化学等知识,题目侧重于等效平衡的计算,为该题的难点,也是易错点,注意理解等效平衡问题.

练习册系列答案
相关题目
甲醇是一种化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO .2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
②.变化的热量数值Q中, Q1与Q2的和是
③.画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,
要求画出压强不同的两条曲线(标出p1、p2,且p1<p2)。
④.在一定温度和压强下,CO和H2催化合成二甲醚反应为:
3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为 甲醇是一种化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g)![]() CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO .2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
①.容器内压强P:2P甲与2P乙与P丙关系是
②.变化的热量数值Q中, Q1 与Q2的和是
③.画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,
要求画出压强不同的两条曲线(标出p1、p2,且p1<p2)。
④.在一定温度和压强下,CO和H2催化合成二甲醚反应为:
3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2