题目内容
17.下列叙述中,正确的是( )| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) $?_{500℃/30MPa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 含 1mol NaOH的稀溶液分别和含1mol CH3COOH、1mol HNO3的稀溶液反应,后者比前者放出的热量多 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol;
C.原子结合成分子会释放能量;
D.弱酸电离吸热.
解答 解:A.根据燃烧热的概念:1mol可燃物完全燃烧生成稳定的氧化物,所放出的热量为燃烧热,水的状态应该为液态,故A错误;
B.0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故B错误;
C.原子结合成分子会释放能量,所以相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量,故C错误;
D.含1mol NaOH的稀溶液分别和含1mol CH3COOH、1mol HNO3的稀溶液反应,醋酸为弱酸电离吸热,所以醋酸发生中和反应放出的热量较少,即后者比前者放出的热量多,故D正确.
故选D.
点评 本题考查学生反应热的有关知识,注意对中和热和燃烧热的概念理解,掌握基础是关键,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
7.下表是元素周期表的一部分,针对表中的 种元素回答下列有关问题:
(1)在这些元素中,最活泼金属元素的原子结构示意图为 ,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
(2)②、③、⑤、⑥、⑦形成的气态氢化物中最稳定的是HF(填化学式).
(3)④与②组成的某种化合物和①与②组成的某种化合物反应生成氧气,写出这两种化合物的电子式 ,
,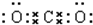 .
.
(4)用电子式表示元素④与⑥构成化合物的形成过程: 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.
(5)能说明④与⑧金属性强弱的事实是分别与冷水反应,K与水的反应现象更剧烈,则钠比钾金属性的弱(举一例)
(6)设计实验方案比较⑥与⑦非金属性强弱
Cl2、S分别与H2反应
硫化钠和氯气反应.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ |
 ,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).(2)②、③、⑤、⑥、⑦形成的气态氢化物中最稳定的是HF(填化学式).
(3)④与②组成的某种化合物和①与②组成的某种化合物反应生成氧气,写出这两种化合物的电子式
 ,
,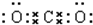 .
.(4)用电子式表示元素④与⑥构成化合物的形成过程:
 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.(5)能说明④与⑧金属性强弱的事实是分别与冷水反应,K与水的反应现象更剧烈,则钠比钾金属性的弱(举一例)
(6)设计实验方案比较⑥与⑦非金属性强弱
Cl2、S分别与H2反应
硫化钠和氯气反应.
8.下列条件下,两瓶气体所含原子数一相等的是( )
| A. | 同质量的N2和CO2 | B. | 同质量的H2和N2 | ||
| C. | 同体积的O2和N2 | D. | 相同物质的量的N2O和CO2 |
2.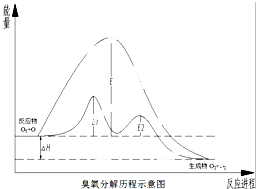 臭氧层中氧分解历程如图所示,下列说法正确的是( )
臭氧层中氧分解历程如图所示,下列说法正确的是( )
总反应:O3+O→2O2
催化反应:①O3+Cl→O2+ClO;②ClO+O→Cl+O2.
 臭氧层中氧分解历程如图所示,下列说法正确的是( )
臭氧层中氧分解历程如图所示,下列说法正确的是( )总反应:O3+O→2O2
催化反应:①O3+Cl→O2+ClO;②ClO+O→Cl+O2.
| A. | 催化反应①②均为放热反应 | |
| B. | 催化剂不能改变该反应的反应热 | |
| C. | ClO是该反应的催化剂 | |
| D. | 在该反应过程中没有化学键的断裂与生成 |
9.下列有关实验的叙述正确的是( )
| A. | 用水润湿的pH试纸来测量溶液的pH | |
| B. | 实验需要480mL 2.0mol•L-1的氢氧化钠溶液.配制该溶液时先称量氢氧化钠固体38.4g,然后再按照溶解、冷却、移液、洗涤、定容、摇匀的步骤进行操作 | |
| C. | 向溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO42- | |
| D. | 用溴水,淀粉、KI溶液比较Br2与I2的氧化性强弱,所需玻璃仪器主要有:试管、胶头滴管 |
6.氢氧化钠不能用玻璃塞保存是因为玻璃中含有( )
| A. | Si | B. | SiO2 | C. | H2SiO3 | D. | Na2SiO3 |
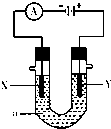 如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: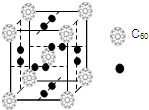 科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.