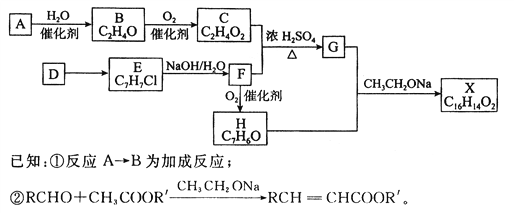
题目内容
【题目】工业上可以利用反应I:2CO(g)+SO2(g)![]() 2CO2(g)+S(l)△H1
2CO2(g)+S(l)△H1
所示原理降低污染气体的排放,并回收燃煤痼气中的硫。
(1)又已知:反应Ⅱ:2CO2(g)![]() 2CO(g)+O2(g)△H2=+566.0kJmol-1
2CO(g)+O2(g)△H2=+566.0kJmol-1
反应Ⅲ:S(l)+O2(g)![]() SO2(g)△H3=-296.0kJmol-1, 则△H1=______________。
SO2(g)△H3=-296.0kJmol-1, 则△H1=______________。
(2)T℃时,将0.100molCO(g)和0.120molSO2(g)充入2L恒容密闭容器中,发生反应I,各物质的物质的量随时间变化如下表所示。

①下列事实能说明该反应达到化学平衡状态的是________(填选项字母)。
A.容器内压强不再改变 B.每消耗2molCO2,同时生成2molCO
C.气体密度不再改变 D.v正(SO2)=2v逆(CO2)
②T℃时,将0.100molCO(g)和0.120molSO2(g)充入容积为2L的恒压密闭容器中,反应达到平衡时,CO2的体积分数与原平衡(恒容)相比将________。(填“增大”、“减小”或“不变”)。
(3)L(L1、L2),X可分别代表压强或温度。右图表示L一定时,反应Ⅱ中CO(g)的体积分数随X的变化关系。
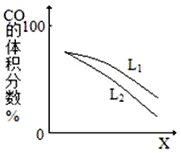
①X代表的物理量为___________。
②判断L1、L2的大小关系,并简述理由:__________。
【答案】 -270 kJmol-1 AC 增大 压强 L1>L2,该反应正反应为吸热反应,压强一定时,温度升高,反应向正向移动,CO的体积分数增大
【解析】(1)已知①CO(g)+O2(g)=CO2(g)△H=-566.0kJmol-1;②S(l)+ O2(g)=SO2(g)△H=-296.0kJmol-1;根据盖斯定律,由方程式①-②,整理可得反应2CO(g)+SO2(g)![]() 2CO2(g)+S(l)△H1 =(-566.0kJmol-1)-(-296.0kJmol-1)=-270kJmol-1;(2)①A.该反应为气体体积减小的反应,所以若容器内压强不再改变,则说明反应处于平衡状态,选项A正确;B.每消耗2molCO2,同时生成2molCO,都是指的逆反应速率大小,无法判断正逆反应速率是否相等,选项B错误;C.恒容密闭容器中,该反应气体质量不守恒,所以气体密度不再改变,说明反应处于平衡状态,选项C正确;D.根据反应速率之比等于计量数之比可知,v正(SO2)=2v逆(CO2),说明正逆反应速率不相等,选项D错误;答案选AC;②由于该反应是气体体积减小的反应,所以恒压过程达到平衡时的压强比恒容过程达到平衡时的压强大,根据压强对平衡的影响可知,增大压强化学平衡向气体体积减小的正反应方向移动,所以反应达到平衡时,SO2 的转化率与原平衡相比增大;(3)①反应Ⅱ的正反应是气体体积增大的吸热反应,由图可知,X越大,CO(g)的体积分数越低,增大压强平衡向逆反应方向移动,则CO(g)的体积分数减小,则X表示压强;②由2CO(g)+SO2(g)
2CO2(g)+S(l)△H1 =(-566.0kJmol-1)-(-296.0kJmol-1)=-270kJmol-1;(2)①A.该反应为气体体积减小的反应,所以若容器内压强不再改变,则说明反应处于平衡状态,选项A正确;B.每消耗2molCO2,同时生成2molCO,都是指的逆反应速率大小,无法判断正逆反应速率是否相等,选项B错误;C.恒容密闭容器中,该反应气体质量不守恒,所以气体密度不再改变,说明反应处于平衡状态,选项C正确;D.根据反应速率之比等于计量数之比可知,v正(SO2)=2v逆(CO2),说明正逆反应速率不相等,选项D错误;答案选AC;②由于该反应是气体体积减小的反应,所以恒压过程达到平衡时的压强比恒容过程达到平衡时的压强大,根据压强对平衡的影响可知,增大压强化学平衡向气体体积减小的正反应方向移动,所以反应达到平衡时,SO2 的转化率与原平衡相比增大;(3)①反应Ⅱ的正反应是气体体积增大的吸热反应,由图可知,X越大,CO(g)的体积分数越低,增大压强平衡向逆反应方向移动,则CO(g)的体积分数减小,则X表示压强;②由2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H1<0,升高温度,CO(g)的体积分数增大,所以T1>T2;压强增大,平衡正向移动,CO(g)的体积分数减小,图中等压时L2对应的CO(g)的体积分数小,则温度L1>L2(或T1>T2);判断理由是该反应正向为吸热反应,压强一定时,温度升高,反应向正向移动,CO的体积分数增大。
2CO2(g)+S(l) △H1<0,升高温度,CO(g)的体积分数增大,所以T1>T2;压强增大,平衡正向移动,CO(g)的体积分数减小,图中等压时L2对应的CO(g)的体积分数小,则温度L1>L2(或T1>T2);判断理由是该反应正向为吸热反应,压强一定时,温度升高,反应向正向移动,CO的体积分数增大。