题目内容
【题目】现用质量分数为98℅、密度为1.84g/mL的浓硫酸来配制480mL 0.2mol/L 的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。完成下列问题:
(1)上述仪器中,在配制稀硫酸时不需要用到的是___________(填序号)
(2)配制过程中需选用的容量瓶规格为___________ mL,经过计算,需要浓硫酸的体积为_______。
(3)在配制过程中,下列操作错误的是____________,能使所配溶液浓度偏高的是___________(填序号)
①洗涤量取浓硫酸后的量筒,并将洗涤液转移至容量瓶中
②为防止变质,稀释后的硫酸溶液应立即就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④移液前,容量瓶中含有少量蒸馏水
⑤量取浓硫酸时,俯视刻度线
【答案】 ②⑦⑧ 500 5.4mL ①②③⑤ ①②
【解析】本题主要考查一定物质的量浓度溶液的配制方法。
(1)上述仪器中,在配制稀硫酸时不需要用到的是②⑦⑧。
(2)配制过程中需选用的容量瓶规格为500mL。c浓=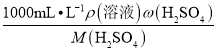 =
=![]() =18.4mol/L。c浓V浓= c稀V稀,V浓=c稀V稀/c浓= 500×0.2/18.4mL=5.4mL,需要浓硫酸的体积为5.4mL。
=18.4mol/L。c浓V浓= c稀V稀,V浓=c稀V稀/c浓= 500×0.2/18.4mL=5.4mL,需要浓硫酸的体积为5.4mL。
(3)在配制过程中,下列操作错误的是①②③⑤,能使所配溶液浓度偏高的是①②。
①所配溶液溶质增多,使所配溶液浓度偏高;
②冷却后溶液体积减小,使所配溶液浓度偏高;
③不可将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水;
④不影响所配溶液浓度;
⑤浓硫酸减少,使所配溶液浓度偏低。

【题目】温度为T时;向2.0L恒容密闭容器中充入1.0mol PCl5;反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s的平均速率v(PCl3)=0.003 2 molL﹣1s﹣1
B.保持其他条件不变;升高温度;平衡时c(PCl3)=0.11 molL﹣1;则反应的△H<0
C.相同温度下;起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2;反应达到平衡前v(正)>v(逆)
D.相同温度下;起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2;达到平衡时;PCl3的转化率小于80%