题目内容
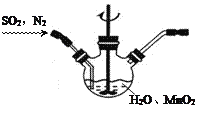
【题目】甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。甲组同学采用如右图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4 g铜。

(1)仪器a的名称是_______。
(2)在铜与硝酸的反应中,硝酸所表现出的化学性质主要有_______。
(3)仪器c中收集的气体主要是_______。(填分子式)
【答案】分液漏斗 酸性和强氧化性 NO
【解析】
(1)根据装置图可知仪器的名称;
(2)根据反应中N元素的化合价部分未变化生成硝酸铜,部分降低生成氮的氧化物分析;
(3)铜与硝酸反应生成盐为硝酸铜,浓硝酸反应产生气体是NO2,稀硝酸反应产生的气体是NO,NO2可与水反应产生NO气体。
(1)根据装置图可知仪器a的名称是分液漏斗;
(2)在Cu与硝酸的反应中,N元素的化合价部分未变化生成硝酸铜,硝酸表现酸性,部分被还原,降低生成氮的氧化物,硝酸表现强氧化性,因此在铜与硝酸的反应中,硝酸表现酸性和氧化性;
(3)Cu与一定浓度的硝酸反应,若硝酸为浓硝酸,发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;若为稀硝酸,则发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。反应产生的气体被水吸收时,若其中含有NO2,在集气瓶中就会发生反应:3NO2+H2O =2HNO3+NO,所以最后收集的到的气体是NO。

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目