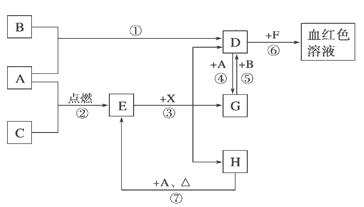
题目内容
【题目】高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解。
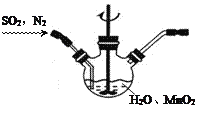
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如右图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2![]() MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
A.MnO2加入前先研磨
B.搅拌
C.提高混合气中N2比例
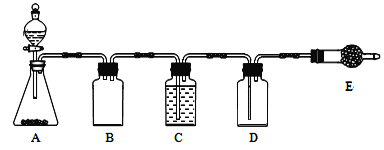
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓) ![]() 2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)
2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
③若用空气代替N2进行实验,会对实验中的SO2利用率_______(选填“增大、无影响、减小”)。
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;② ……;③在70-80℃下烘干得到纯净干燥的MnCO3固体。
步骤②需要用到的试剂有________。
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明KSP(MnCO3) < KSP(NiCO3):________。
(已知NiCO3为难溶于水的浅绿色固体)
【答案】 AB abef 减小 水、盐酸酸化的BaCl2溶液、乙醇 向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色。
【解析】试题分析:(1)①根据影响反应速率的因素分析;②Na2SO3+2H2SO4(浓) ![]() 2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理;③氧气能氧化SO2;(2)步骤②为洗涤沉淀、验证洗涤是否干净,根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”分析所需试剂;(3)一种沉淀容易转化为比它更难溶的沉淀;
2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理;③氧气能氧化SO2;(2)步骤②为洗涤沉淀、验证洗涤是否干净,根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”分析所需试剂;(3)一种沉淀容易转化为比它更难溶的沉淀;
解析:(1)①A.MnO2加入前先研磨,增大接触面积,加快反应速率,故A正确; B.搅拌加快反应速率,故B正确; C.提高混合气中N2比例,H2SO3浓度降低,反应速率减慢,故C错误;②Na2SO3+2H2SO4(浓) ![]() 2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理,所以应选择的装置有abef;③氧气能氧化SO2,所以空气代替N2进行实验,实验中的SO2利用率减小;(2)根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”,先用蒸馏水洗涤,用盐酸酸化的BaCl2溶液验证洗涤是否干净,再用乙醇洗涤,所以所需试剂是水、盐酸酸化的BaCl2溶液、乙醇;(3)向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色,可证明KSP(MnCO3) < KSP(NiCO3)。
2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理,所以应选择的装置有abef;③氧气能氧化SO2,所以空气代替N2进行实验,实验中的SO2利用率减小;(2)根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”,先用蒸馏水洗涤,用盐酸酸化的BaCl2溶液验证洗涤是否干净,再用乙醇洗涤,所以所需试剂是水、盐酸酸化的BaCl2溶液、乙醇;(3)向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色,可证明KSP(MnCO3) < KSP(NiCO3)。

【题目】下列各组物质之间不能通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| SiO2 | Na2SiO3 | Si | H2SiO3 |
B | Na2O | Na2O2 | Na | NaOH | |
C | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
D | FeCl2 | FeCl3 | Fe | CuCl2 |
A. A B. B C. C D. D