题目内容
【题目】25℃时,向盛有50mLpH=2的HA溶液的绝热容器中加入pH =13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是
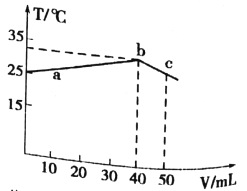
A. a→b 的过程中,混合溶液中可能存在:c(A-)=c(Na+)=c(H+) =c(OH-)
B. HA的物质的量浓度为0.01mol/L
C. b点时,溶液中存在:c(Na+)>c(A-)>c(OH-)>c(H+)
D. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
【答案】C
【解析】A.NaA呈碱性,HA呈酸性,a→b的过程中,混合溶液中可能呈中性,存在:c(A-)=c(Na+)>c(H+)=c(OH-),不可能出现c(A-)=c(Na+)=c(H+)=c(OH-),故A错误;B、恰好中和时混合溶液温度最高,即b点,此时消耗氢氧化钠=0.04L×0.1mol/L=0.004mol,得出50mlHA的浓度=![]() =0.08mol/L,故B错误;C. b点时恰好中和,溶质为NaA,水解显碱性,溶液中存在: c(Na+)>c(A-)>c(OH-)>c(H+),故C正确;D.b→c的过程中,温度降低的原因是溶液中发生了反应恰好生成NaA,继续滴加氢氧化钠溶液不再发生反应,溶液温度降低,故D错误;故选C。
=0.08mol/L,故B错误;C. b点时恰好中和,溶质为NaA,水解显碱性,溶液中存在: c(Na+)>c(A-)>c(OH-)>c(H+),故C正确;D.b→c的过程中,温度降低的原因是溶液中发生了反应恰好生成NaA,继续滴加氢氧化钠溶液不再发生反应,溶液温度降低,故D错误;故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目