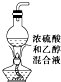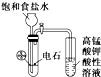题目内容
【题目】实验室要用密度为1.17g/cm3 , 溶质质量分数为36.5%的浓盐酸配制80mL1.0molL﹣1稀盐酸溶液.请回答下列问题:
(1)完成本实验所必需用到的仪器有:量筒、烧杯、玻璃棒、、 .
(2)所用浓盐酸的物质的量浓度;需用量筒量取浓盐酸mL.
(3)下列操作会使所配溶液浓度偏低的是 .
A.量取浓盐酸读数时,仰视刻度线
B.倒出量筒内的液体后,没有洗涤量筒
C.转移前,容量瓶中含有少量蒸馏水
D.将未冷却的溶液沿玻璃棒注入容量瓶中
E.定容时,仰视刻度线
F.定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线.
【答案】
(1)胶头滴管,100mL容量瓶
(2)11.7mol?L﹣1,8.5
(3)E,F
【解析】解:(1)配制一定物质的量浓度溶液的步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,用到的仪器:量筒、胶头滴管、烧杯、玻璃棒、容量瓶,80mL1.0molL﹣1稀盐酸溶液应选择100mL容量瓶,所以还缺少的仪器:胶头滴管、100ml容量瓶;
所以答案是:胶头滴管、100ml容量瓶;
(2)密度为1.17g/cm3,溶质质量分数为36.5%的浓盐酸物质的量浓度c= ![]() =11.7mol/L,
=11.7mol/L,
配制80mL1.0molL﹣1稀盐酸,应选择100mL容量瓶,实际配制500mL溶液,设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:11.7mol/L×V=1.0mol/L×100mL,解得V=8.5mL;
所以答案是:11.7 molL﹣1;8.5;
(3)A.量取浓盐酸读数时,仰视刻度线,导致浓盐酸体积偏大,溶质的物质的量偏大,溶液浓度偏,故A不选;
B.倒出量筒内的液体后,没有洗涤量筒,属于正常操作,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故B不选;
C.转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不选;
D.将未冷却的溶液沿玻璃棒注入容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故D不选;
E.定容时,仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故E选;
F.定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低,故F选;
故选:E F.
【考点精析】利用配制一定物质的量浓度的溶液对题目进行判断即可得到答案,需要熟知配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】下列实验方案中,能达到相应实验目的是( )
A | B | C | D | |
方案 |
|
|
|
|
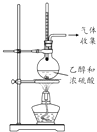
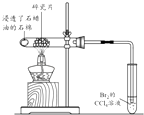
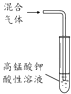
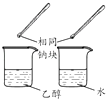
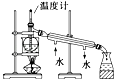
目的 | 利用乙醇的消去反应制取乙烯 | 验证石蜡油分解的产物是乙烯 | 检验乙烯、乙炔混合气中的乙烯 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
A.A
B.B
C.C
D.D