题目内容
【题目】某水煤气工厂在1 200 ℃时测得反应H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K为2.25。若反应从H2(g)和CO2(g)开始,且H2(g)和CO2(g)的初始浓度均为0.010 mol/L时,计算
H2O(g)+CO(g)的平衡常数K为2.25。若反应从H2(g)和CO2(g)开始,且H2(g)和CO2(g)的初始浓度均为0.010 mol/L时,计算
(1)各物质的平衡浓度。
(2)H2(g)和CO2(g)的平衡转化率。
【答案】(1)0.004、0.004、0.006、0.006;(2)60%。
【解析】设H2(g)的转化浓度为x,由题意,列三段式:
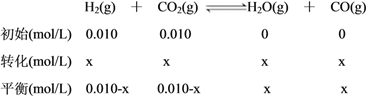
因为K=![]() ,代入数据得:
,代入数据得: 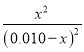 =2.25,所以
=2.25,所以![]() =1.5,解得:x=0.006,0.010-x=0.010-0.006=0.004。
=1.5,解得:x=0.006,0.010-x=0.010-0.006=0.004。
(1)由上述解答过程可得,H2(g)、CO2(g)、H2O(g)、CO(g)的平衡浓度(单位:mol/L)依次为:0.004、0.004、0.006、0.006。
(2)H2(g)和CO2(g)的平衡转化率都是: ![]() =
=![]() ×100%=60%。
×100%=60%。

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
【题目】现有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
浓度 | c(OH-)=10-3mol/L | c(OH-)=10-3mol/L | c(H+)=10-3mol/L | c(H+)=10-3mol/L |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的c(H+)均变小
B. 把0.2 mol·L-1的③加水稀释,则溶液中的![]() 变大
变大
C. 分别加水稀释10倍,①和②的c(OH-)大小关系为①>②
D. 将①和④等体积混合,则混合后溶液中溶质仅有NH4Cl

