题目内容
下列有关实验原理或操作叙述正确的是
- A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解,是因为铜可直接与1mol/L稀硫酸反应
- B.用CCl4萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
- C.向某溶液中加入新制Cu(OH)2,加热后出现红色沉淀,说明该溶液中一定含醛类物质
- D.测氯水的pH值,可用干燥洁净的玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
B
分析:A.NO3-在酸性条件下具有强氧化性,可与铜反应;
B.CCl4密度比水大;
C.向某溶液中加入新制Cu(OH)2,加热后出现红色沉淀,说明有机物中含有-CHO;
D.氯水可使pH试纸先变红后褪色.
解答:A.过量的铜屑与稀硝酸作用,反应停止后,溶液中存在NO3-,再加入1mol/L稀硫酸,是由于NO3-在酸性条件下具有强氧化性,可与铜反应,而铜和稀硫酸不反应,故A错误;
B.CCl4密度比水大,分液时,在分液漏斗的下层,有机层从分液漏斗的下端放出,故B正确;
C.向某溶液中加入新制Cu(OH)2,加热后出现红色沉淀,说明有机物中含有-CHO,但不一定为醛类物质,可能为还原性糖、甲酸或甲酸酯等物质,故C错误;
D.氯水可使pH试纸先变红后褪色,充分反应后为白色,无法测pH,故D错误.
故选B.
点评:本题考查较为综合,涉及硝酸的性质、有机物的分离、检验以及氯水的性质,题目难度不大,注意相关物质的性质,学习中注意积累.
分析:A.NO3-在酸性条件下具有强氧化性,可与铜反应;
B.CCl4密度比水大;
C.向某溶液中加入新制Cu(OH)2,加热后出现红色沉淀,说明有机物中含有-CHO;
D.氯水可使pH试纸先变红后褪色.
解答:A.过量的铜屑与稀硝酸作用,反应停止后,溶液中存在NO3-,再加入1mol/L稀硫酸,是由于NO3-在酸性条件下具有强氧化性,可与铜反应,而铜和稀硫酸不反应,故A错误;
B.CCl4密度比水大,分液时,在分液漏斗的下层,有机层从分液漏斗的下端放出,故B正确;
C.向某溶液中加入新制Cu(OH)2,加热后出现红色沉淀,说明有机物中含有-CHO,但不一定为醛类物质,可能为还原性糖、甲酸或甲酸酯等物质,故C错误;
D.氯水可使pH试纸先变红后褪色,充分反应后为白色,无法测pH,故D错误.
故选B.
点评:本题考查较为综合,涉及硝酸的性质、有机物的分离、检验以及氯水的性质,题目难度不大,注意相关物质的性质,学习中注意积累.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
 (1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)
(1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)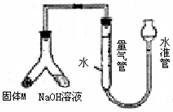 某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验. 测定剩余固体质量.
测定剩余固体质量. 测定数据
测定数据 Mg3N2]
Mg3N2] 测定生成无色气体的体积
测定生成无色气体的体积