题目内容
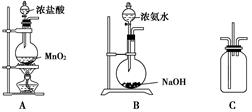
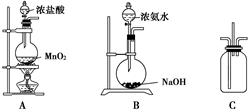
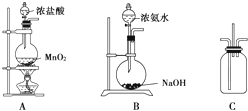
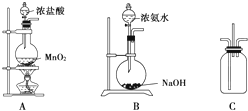 某校学生利用下图所示装置验证氯气与氨气之间的反应(部分装置已略去).其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
某校学生利用下图所示装置验证氯气与氨气之间的反应(部分装置已略去).其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.请回答下列问题:
(1)装置A中发生反应的离子方程式为
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
(2)装置B中浓氨水与NaOH固体混合可制取氨气,其原因是
NaOH具有吸水性并溶于水放热,且氢氧根离子浓度增大,有利于平衡向生成氨气的方向移动
NaOH具有吸水性并溶于水放热,且氢氧根离子浓度增大,有利于平衡向生成氨气的方向移动
(3)装置C中氯气和氨气相遇,有浓厚的白烟并在容器内壁凝结,同时生成一种常见的气体单质,该反应的化学方程式为
3Cl2+8NH3═6NH4Cl+N2
3Cl2+8NH3═6NH4Cl+N2
.(4)将装置C中反应生成的固体溶于水,所得溶液中离子浓度由大到小的顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
.分析:(1)实验室利用二氧化锰和浓盐酸制取氯气,反应生成氯化锰、氯气和水;
(2)可利用固体与液体来制取氨气,NaOH溶于水放热,且氢氧根离子浓度增大,有利于氨气的逸出;
(3)氯气和氨气相遇,有浓厚的白烟并在容器内壁凝结,同时生成一种常见的气体单质,白烟为氯化铵、单质为氮气;
(4)氯化铵溶液中,铵根离子水解使溶液显酸性.
(2)可利用固体与液体来制取氨气,NaOH溶于水放热,且氢氧根离子浓度增大,有利于氨气的逸出;
(3)氯气和氨气相遇,有浓厚的白烟并在容器内壁凝结,同时生成一种常见的气体单质,白烟为氯化铵、单质为氮气;
(4)氯化铵溶液中,铵根离子水解使溶液显酸性.
解答:解:(1)实验室利用二氧化锰和浓盐酸制取氯气,反应生成氯化锰、氯气和水,离子反应为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)利用NaOH固体与浓氨水来制取氨气,是因NaOH具有吸水性并溶于水放热,且氢氧根离子浓度增大,有利于平衡向生成氨气的方向移动,从而氨气逸出,
故答案为:NaOH具有吸水性并溶于水放热,且氢氧根离子浓度增大,有利于平衡向生成氨气的方向移动;
(3)氯气和氨气相遇,有浓厚的白烟并在容器内壁凝结,同时生成一种常见的气体单质,白烟为氯化铵、单质为氮气,该反应为3Cl2+8NH3═6NH4Cl+N2,
故答案为:3Cl2+8NH3═6NH4Cl+N2;
(4)氯化铵溶液中,铵根离子水解使溶液显酸性,则溶液中离子浓度为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-).
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)利用NaOH固体与浓氨水来制取氨气,是因NaOH具有吸水性并溶于水放热,且氢氧根离子浓度增大,有利于平衡向生成氨气的方向移动,从而氨气逸出,
故答案为:NaOH具有吸水性并溶于水放热,且氢氧根离子浓度增大,有利于平衡向生成氨气的方向移动;
(3)氯气和氨气相遇,有浓厚的白烟并在容器内壁凝结,同时生成一种常见的气体单质,白烟为氯化铵、单质为氮气,该反应为3Cl2+8NH3═6NH4Cl+N2,
故答案为:3Cl2+8NH3═6NH4Cl+N2;
(4)氯化铵溶液中,铵根离子水解使溶液显酸性,则溶液中离子浓度为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-).
点评:本题考查实验室制取氯气、氨气及其物质的性质,明确反应原理是解答本题的关键,并熟悉物质之间的反应、盐类水解等知识来解答,题目难度不大.

练习册系列答案
相关题目