题目内容
下列实验的操作、现象和解释或结论都正确的是
| | 操作 | 现象 | 解释或结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3晶体 |
| C | 将Al2(SO4)3溶液蒸干 | 有白色固体生成 | Al3++3H2O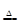 Al(OH)3↓+3H+ Al(OH)3↓+3H+ |
| D | 将Na放入CuSO4溶液中 | 有红色固体析出 | 2Na+Cu2+=Cu+2Na+ |
B
试题分析:A.向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4,就相当于在FeSO4中滴加HNO3。由于Fe2+有还原性,而HNO3有氧化性,二者会发生氧化还原反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。溶液会因含有Fe3+变为黄色。错误。B.向饱和Na2CO3溶液中通入足量CO2,发生反应:Na2CO3+CO2+H2O= 2NaHCO3↓。由于NaHCO3的溶解度比Na2CO3小。所以会结晶析出,而使溶液变浑浊。正确。C.将Al2(SO4)3溶液蒸干, Al2(SO4)3是强酸弱碱盐水解产生硫酸和氢氧化铝。由于硫酸没有挥发性,所以二者会重新反应得到Al2(SO4)3。当溶液蒸干后得到的白色固体就是Al2(SO4)3。错误。D.将Na放入CuSO4溶液中,由于Na非常活泼,很容易与溶液中的溶剂水发生反应:2Na+2H2O=2NaOH+H2↑,产生的NaOH再与CuSO4发生复分解反应2NaOH+ CuSO4=Cu(OH)2↓+Na2SO4.因此不会产生黄色固体。反应原理也错误。

练习册系列答案
相关题目