题目内容
某溶液可能含有Clˉ、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
由此可知原溶液中
| A.至少存在5种离子 |
| B.Clˉ一定存在,且c(Clˉ)≥0.4mol/L |
| C.SO42ˉ、NH4+、一定存在,Clˉ可能不存在 |
| D.CO32ˉ、Al3+一定不存在,K+可能存在 |
B
解析试题分析:溶液中加入过量NaOH溶液,加热,得到0.02mol气体,说明含有NH4+0.02mol,产生红褐色沉淀,灼烧后得1.6g固体,说明含有Fe3+ 0.02mol,加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀,说明含有SO42- 0.02mol。根据电荷守恒,溶液中必须含有0.04molCl- 。A、至少含有4种离子,错误;B、根据题意正确;C、氯离子必须存在,错误;D、Al3+可能存在,错误。
考点:考查了溶液中离子的共存问题。

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
有下列物质:①石墨 ②铜丝 ③氧气 ④二氧化碳 ⑤食盐 ⑥H2SO4 ⑦水 ⑧硫酸钡 ⑨金刚石,以下组合正确的是
| A.能导电的有①②⑤⑦ | B.属于电解质的有④⑤⑥⑦⑧ |
| C.属于强电解质的有⑤⑧⑨ | D.既不属于电解质又不属于非电解质的有①②③⑨ |
下列表述或化学用语书写正确的是
| A.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性: Ba2++OH-+H++SO2- 4=BaSO4↓+H2O |
| B.稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ |
| C.FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O |
D.金属铝与氧化镁发生铝热反应:2Al+3MgO 3Mg+Al2O3 3Mg+Al2O3 |
下列各组离子在指定溶液中能大量共存的是
| A.常温下,呈碱性的溶液:K+、AlO2-、CO32-、Na+ |
| B.含Fe3+的溶液中:K+、NH4+、Cl-、I- |
| C.中性溶液:Fe3+、Al3+、NO3-、SO42- |
| D.无色溶液中:K+、AlO2-、NO3-、HCO3- |
下列各组离子在指定环境中一定能大量共存的是 ( )
| A.使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| B.与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- |
| C.使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
| D.pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- |
某同学在实验室中进行如下实验:
| 编号 | I | II | III |
| 实验 | 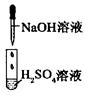 |  | 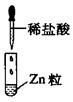 |
| 现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
A.I中混合前后溶液中各离子种类、个数均不变
B.II中反应前后溶液中Cu2+、Cl-浓度均未变
C.II中BaCl2替换为Ba(NO3)2溶液,发生的离子反应相同
D.III中发生的反应属于置换反应,不属于离子反应
下列离子方程式正确的是
| A.铁与盐酸的反应:Fe + 2H+ = Fe3+ + H2↑ |
| B.碳酸钡溶于醋酸:BaCO3+2H+ = Ba2++H2O+CO2↑ |
| C.铜片插入硝酸银溶液中: Cu +Ag+ = Cu2++ Ag |
| D.硫酸氢钾与氢氧化钠:OH-+H+=H2O |
 ,Na+,HSO
,Na+,HSO ,PO
,PO ,MnO
,MnO
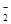 ,NO
,NO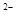 ,SO
,SO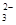
 ,CO
,CO ,Cl
,Cl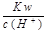 ="0.1" mol/L的溶液中:Na+,K+,SO
="0.1" mol/L的溶液中:Na+,K+,SO