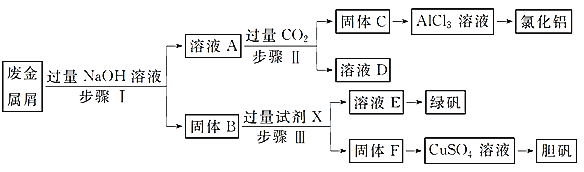
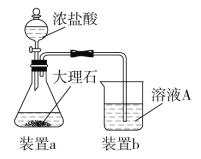
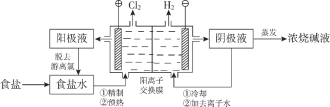
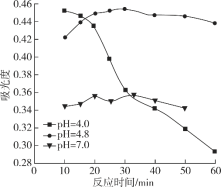
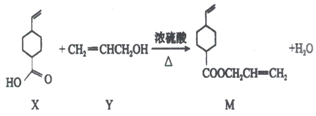
题目内容
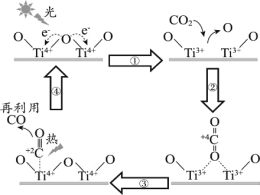
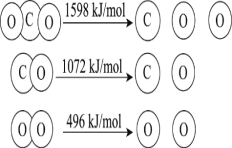
【题目】以TiO2为催化剂的光热化学循环分解CO2反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
下列说法错误的是( )
A.过程①中吸收能量使钛氧键发生了断裂
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以提高化学反应速率
D.2mol二氧化碳完全分解成2mol一氧化碳和1mol氧气需要吸热30kJ
【答案】D
【解析】
A.由图可知,过程①中钛氧键发生了断裂,断键吸收能量,A正确;
B.根据图示,该反应中,光能和热能转化为化学能,B正确;
C.使用TiO2作催化剂可以降低反应的活化能,从而提高化学反应速率,C正确;
D.反应2CO2(g) =2CO(g) + O2(g)的ΔH=1598kJ/mol×2- 1072kJ/mol×2-496 kJ/mol=+556 kJ/mol ,即2mol二氧化碳完全分解成2mol一氧化碳和1mol氧气需要吸热556kJ,D错误;
答案选D。

【题目】溴元素主要以Br-形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如图。已知:常温下溴呈液态,深红棕色,易挥发。
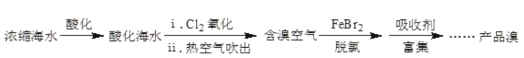
(1)氧化:请写出i中的化学方程式_____。
(2)脱氯:除去含溴空气中残留的Cl2。
①具有脱氯作用的离子是_____。
②溶液失去脱氯作用后,补加FeBr2或加入_____,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO![]() 和Br-。再用H2SO4酸化后可以得到Br2。写出加入H2SO4酸化生成Br2的离子方程式_____。
和Br-。再用H2SO4酸化后可以得到Br2。写出加入H2SO4酸化生成Br2的离子方程式_____。
(4)探究NaBr溶液与H2SO4溶液反应时H2SO4浓度对生成Br2的影响,实验如下:
序号 | A | B | C |
试剂组成 | 1mol/LNaBr 20%H2SO4 | 1mol/LNaBr 98%H2SO4 | 将B中反应后溶液用水 稀释 |
实验现象 | 无明显现象 | 溶液呈棕红色,放热 | 溶液颜色变得很浅 |
①B中溶液呈棕红色说明产生了_____。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由。若认为乙同学的分析合理,请进一步设计实验方案证明。请从甲乙同学的说法中任选一个作答。
认为甲合理的理由_____(具体反应)。
认为乙合理的实验方案_____。