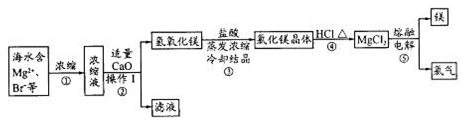
题目内容
废旧电池进入环境后,对人体带来一系列的致畸、致癌、致变等危害。废电池中主要有铜帽(含Cu、Zn)、锌壳、铁片、石墨、填充物(MnO2、NH4Cl),对废旧电池进行资源化处理的工艺流程如下:
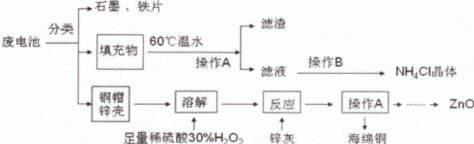
(1)操作A的名称为 ,滤渣的成分为 。
(2)填充物用60℃温水溶解,目的是为了加快溶解速率,但必须控制温度不能太高,其原因是 。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示) 。铜帽溶解完全后,需将溶液中过量的H2O2除去,除去H2O2的简便方法是 。
(4)碱性锌锰电池的电解质为KOH,总反应为:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,其负极的电极反应式为 。

(1)操作A的名称为 ,滤渣的成分为 。
(2)填充物用60℃温水溶解,目的是为了加快溶解速率,但必须控制温度不能太高,其原因是 。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示) 。铜帽溶解完全后,需将溶液中过量的H2O2除去,除去H2O2的简便方法是 。
(4)碱性锌锰电池的电解质为KOH,总反应为:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(14分)(1)过滤(2分) MnO2(2分)
(2)防止高温下NH4Cl分解(2分,其它合理解释也给分)
(3)①Cu+H2O2+H2SO4==CuSO4+2H2O(3分,不配平扣1分,化学式错不给分)
②加热(2分)
(4)Zn-2eˉ+2OHˉ==Zn(OH)2(3分)
(2)防止高温下NH4Cl分解(2分,其它合理解释也给分)
(3)①Cu+H2O2+H2SO4==CuSO4+2H2O(3分,不配平扣1分,化学式错不给分)
②加热(2分)
(4)Zn-2eˉ+2OHˉ==Zn(OH)2(3分)
试题分析:(1)根据混合物分离提纯的方法可知,得到滤渣和滤液的方法是过滤,则操作A的名称为过滤或趁热过滤,用60℃温水溶解MnO2、NH4Cl的混合物,得到的滤渣是MnO2,为了防止冷却时结晶析出NH4Cl,加入的蒸馏水需过量,且最好趁热过滤;(2)首先,NH4Cl是强酸弱碱盐,温度太高促进其彻底水解,变为受热易分解的NH3?H2O和易挥发的HCl,降低NH4Cl的产率;其次,温度太高,NH4Cl受热易分解为NH3和HCl气体;(3)Cu是氢后金属,不能直接溶于稀硫酸,过氧化氢是常见的氧化剂,在酸性条件下能溶解铜单质,根据化合价升降总数相等、铜硫氢等原子守恒可得:Cu+H2O2+H2SO4==CuSO4+2H2O;除杂试剂需过量,过量试剂需除去,双氧水受热依分解,硫酸铜可以催化其分解,因此加热是除去过氧化氢的简便方法;而加入过量的锌灰(Zn)可以除去Cu2+、过量的稀硫酸,过滤得到的滤渣为海绵铜(Cu),滤液为硫酸锌溶液,以滤液为原料可以制备ZnO;(4)根据总反应式中化合价升高的元素可知,负极的主要反应物→产物为:Zn→Zn(OH)2;由化合价升高总数等于失去电子数可得:Zn-2eˉ→Zn(OH)2;根据电荷守恒和原子守恒可知,负极反应式为Zn-2eˉ+2OHˉ==Zn(OH)2。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
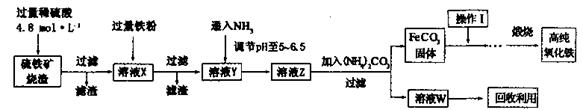
 形式存在
形式存在