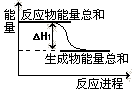��Ŀ����
(һ)����2 mol SO2��1 mol O2������1L�������л�ϣ���һ�������·������·�Ӧ��2SO2(g)��O2 (g) 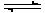 2SO3 (g)��������2s����SO3��Ũ��Ϊ0.6 mol/ L���Լ��㣺(1)O2�Ļ�ѧ��Ӧ����V(O2)= �� (2)2sʱ��O2Ũ�� ��
2SO3 (g)��������2s����SO3��Ũ��Ϊ0.6 mol/ L���Լ��㣺(1)O2�Ļ�ѧ��Ӧ����V(O2)= �� (2)2sʱ��O2Ũ�� ��
(��)��ij�¶�ʱ����2 L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯��������ͼ��ʾ��
��1��X��ת������
��2����ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3����Ӧ�ӿ�ʼ��2����ĩ����Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)= ��
��4������Ӧ���е��� min���÷�Ӧ�ﵽƽ�⡣
(1) �ԣ�O2)="0" .15mol/��L��s�� c(O2��=0.7 mol/L
(2) 30% 3X+Y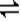 2Z 0.05mol/(l.��min) 2
2Z 0.05mol/(l.��min) 2
�������������(һ) 2s����SO3��Ũ��Ϊ0.6 mol/ L������V(O2)="0.5" V(SO2)=0.5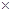 0.6/2=0 .15mol/��L��s����2sʱ��O2Ũ��=1-0 .15
0.6/2=0 .15mol/��L��s����2sʱ��O2Ũ��=1-0 .15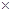 2=0.7 mol/L��
2=0.7 mol/L��
(��)��ͼ����֪����ÿ��Ӧ0.1molY����0.3molX��������0.2mol��Z,�����䷴Ӧ�Ļ�ѧ����ʽΪ3X+Y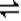 2Z�� X��ת����=0.3/1
2Z�� X��ת����=0.3/1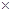 100%=30%����3����Ӧ�ӿ�ʼ��2����ĩ����Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)=0.2/2/2= 0.05mol/(l.��min)����4����ͼ���Կ���������Ӧʱ��Ϊ2minʱ�������ʵ�Ũ�Ⱦ����ٱ仯�����Ե���Ӧ���е���2min���÷�Ӧ�ﵽƽ�⡣
100%=30%����3����Ӧ�ӿ�ʼ��2����ĩ����Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)=0.2/2/2= 0.05mol/(l.��min)����4����ͼ���Կ���������Ӧʱ��Ϊ2minʱ�������ʵ�Ũ�Ⱦ����ٱ仯�����Ե���Ӧ���е���2min���÷�Ӧ�ﵽƽ�⡣
���㣺��ѧƽ�⣬��Ӧ����
���������⿼���˻�ѧƽ�⣬��Ӧ���ʵ���ؼ��㣬�Ǹ߿�������ص㣬�����ۺ���ǿ�����ѶȲ���

 ״Ԫ����ϵ�д�
״Ԫ����ϵ�д� ͬ������ϵ�д�
ͬ������ϵ�д� ��2012?������һģ����a mol��Na2O2��bmol NaHCO3�����Ϻ����ܱ������м��ȵ�250�棬�����ַ�Ӧ������NaHCO3�ֽ������CO2��Na2O2��Ӧ���H2O����Na2O2��Ӧ��
��2012?������һģ����a mol��Na2O2��bmol NaHCO3�����Ϻ����ܱ������м��ȵ�250�棬�����ַ�Ӧ������NaHCO3�ֽ������CO2��Na2O2��Ӧ���H2O����Na2O2��Ӧ�� CH3OH(g) ��H1
CH3OH(g) ��H1