题目内容
海洋是一个巨大的化学资源宝库,下图是海水加工的示意图:
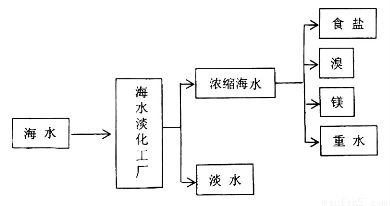
(1)海水淡化工厂通常采用的制备淡水的方法有????????????????????????? (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中试剂A的化学式????????????? ,
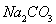 溶液中发生反应的化学方程式为?????????????????????? 。
溶液中发生反应的化学方程式为?????????????????????? 。
(3)制备金属镁是通过电解熔融的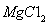 ,而不用MgO,其原因是
,而不用MgO,其原因是
?????????????????????????????????????????????????????????????????????????? 。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2。海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是?????????? 。电解食盐水在离子交换膜电解槽中进行,阳离子交换膜的作用是????????? 。
(1)蒸馏法、电渗析法
(2)Cl2? 3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑
(3)MgO熔点很高,会消耗大量电能
(4)用试剂处理后的盐水中还含有少量的Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;防止H2与Cl2混合发生爆炸,同时防止Cl?进入阴极室,这样可以获得纯净的NaOH
【解析】
试题分析:(1)海水淡化工厂通常采用的制备淡水的方法有:蒸馏法、电渗析法。
(2)A的作用为把Br?氧化为Br2,所以A为Cl2;Br2在Na2CO3溶液中发生歧化反应生成NaBr、NaBrO3,化学方程式为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑
(3)MgO的沸点大于MgCl2,会消耗大量电能,为节约能源,应电解熔融的MgCl2,而不用MgO
(4))用试剂处理后的盐水,杂质并没有除彻底,还含有少量的Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;阳离子交换膜只允许阳离子通过,Cl?、Cl2与H2不能通过,所以可防止H2与Cl2混合发生爆炸,同时防止Cl?进入阴极室,这样可以获得纯净的NaOH。
考点:本题考查制备淡水的方法、化学流程图的分析、化学方程式的书写、试剂的选择、交换膜的作用。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为:
(2)实验室用二氧化锰制取氯气的化学方程式为:
(3)实验室中模拟Br-→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现.写出Br-→Br2的转化离子方程式为:
(4)实验室制备氯气的反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如下图),再把已称好50.0g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应.观察读数变化如下表所示:

| CaCO3用量 | 未加CaCO3时 | 加约四分之一时 | 加一半时 | 全部加完时 |
| 读数/g | 318.3 | 325.3 | 334.5 | 359.5 |
①实验中产生的CO2气体质量为
②残余液中盐酸的物质的量浓度为(结果精确到小数点后一位)